Guía Práctica del laboratorio microbiológico en agua y alimentos (Parte IV)
"Lo poco que hoy soy, lo soy en razón de todo lo que he aprendido"
(El Autor)
GUÍA PRACTICA del LABORATORIO MICROBIOLOGICO
en AGUA y ALIMENTOS (Parte IV)
f. TEMPERATURA
El
hombre ha aprendido a lo largo de los siglos, por vía empírica, a explotar las
temperaturas extremas para la conservación de sus alimentos. Observó que
enfriándolos se retrasaba su alteración; que manteniéndolos en estado congelado
se conservaban durante largos periodos de tiempo; que el calentamiento
eliminaba los agentes de la alteración de origen microbiano y que, si se
evitaba la recontaminacion mediante un envasado adecuado, los alimentos
térmicamente tratados podían conservarse incluso a la temperatura ambiente.
Del mismo
modo, averiguó que algunos alimentos, mantenidos a la temperatura ambiente,
sufren modificaciones de sus propiedades organolépticas, pero siguen siendo
aptos para el consumo y se tornan considerablemente más estables. Así se fue
desarrollando una amplia variedad de alimentos fermentados, muchos de ellos
asociados en su origen a una determinada raza y a los alimentos frescos
localmente disponibles. La sociedad moderna consume cientos de productos
fermentados que, pese a que un buen número de ellos se han visto favorecidos
por la aplicación de los conocimientos científicos, recientemente descubiertos,
siguen siendo esencialmente idénticos a los que se consumían hace varias
generaciones.

Las fermentaciones generalmente implicadas son la láctica y la alcohólica, o una combinación de ambas. Si el alimento original contiene un azúcar fermentescible y se encuentra moderadamente salado es probable que se produzca una fermentación láctica Si su sabor es ácido,lo esperable es una fermentación alcohólica. En cualquier caso, para conseguir las características deseadas en el producto fermentado de que se trate, resulta esencial el control de la temperatura, generalmente un ambiente frío. A lo largo de milenios de la historia de la humanidad, sólo las dos o tres últimas generaciones han sido capaces de capitalizar para la conservación y las fermentaciones de los alimentos los principios científicos en que estos procesos se basan. El control y la manipulación de la temperatura se encuentran entre los factores más críticos precisos para el logro de un suministro alimenticio que reúna las propiedades sanitarias organolépticas correctas. En este capítulo describiremos los principios científicos relacionados con la explotación de la temperatura en el control de los microorganismos que de ordinario pueden encontrarse en los alimentos consumidos por el hombre.
Probablemente sea la temperatura el más importante de los factores ambientales que afectan a la viabilidad y el desarrollo microbianos. Aunque el crecimiento microbiano es posible entre alrededor de -8 y hasta +90º C, el rango de temperatura que permite el desarrollo de un determinado microorganismo rara vez excede de los 37º C. Dentro de este rango, la temperatura afecta a la longitud de la fase de latencia, a la velocidad de crecimiento, al número final de células, a las necesidades nutritivas y a la composición química y enzimática de las células. Cualquier temperatura por encima de la máxima de crecimiento de un determinado microorganismo resulta letal para el mismo, y cuanto más elevada sea la temperatura en cuestión tanto más rápida será la pérdida de viabilidad. Sin embargo, la letalidad de cualquier exposición a una determinada temperatura por encima de la máxima de crecimiento depende de la termorresistencia que es fundamentalmente una característica del microorganismo considerado.

Los microorganismos sobreviven a temperaturas inferiores a la mínima de crecimiento. Los efectos letales de la refrigeración y la congelación dependen del germen considerado, del microambiente y de las condiciones de tiempo y temperatura de almacenamiento. Algunos microorganismos permanecen viables durante largos periodos de tiempo si se mantienen congelados a temperaturas suficientemente bajas. Tras un periodo de ajuste o adaptación al ambiente (fase de latencia) comienza el crecimiento que se acelera hasta alcanzar una etapa de multiplicación rápida y constante, de crecimiento exponencial, denominada fase logarítmica o exponencial. La defección de nutrientes y el acúmulo de metabolitos tóxicos termina frenando la velocidad de crecimiento hasta que alcanza un punto en el que muertes y divisiones celulares se igualan, permaneciendo así la población constante durante un periodo al que se conoce con el nombre de fase estacionaria. A esta fase en la que la población es máxima, sigue otra en la que va progresivamente decreciendo a causa de las muertes celulares. La influencia de la temperatura sobre la actividad microbiana es más acusada en los alimentos húmedos, es decir a actividades de agua (aw) superiores a 0,85. La mayor parte de las bacterias son incapaces de seguir creciendo a actividades de agua inferiores.

A las temperaturas más elevadas, hay un rango en el que la velocidad de crecimiento, tiempo de generación, se mantiene relativamente estable (óptimo de crecimiento); este rango se halla en torno a 20 – 30º C para los psicrótrofos y 35 – 45° C para los mesófilos. A temperaturas sólo ligeramente superiores a las que son precisas para un crecimiento óptimo se da una inhibición del mismo. Las bacterias termófilas responden de un modo similar, pero su gráfica de crecimiento se encuentra sustancialmente desplazada hacia la derecha. La naturaleza de la respuesta a cualquier temperatura dada se ve profundamente afectada por el tiempo de exposición a la misma. El crecimiento en un ambiente confinado, incluso a la temperatura óptima, cesa llegado un momento determinado a causa del gradual agotamiento de nutrientes. En atención a sus rangos de temperatura de crecimiento, pueden distinguirse cuatro grupos fisiológicos fundamentales de bacterias: termófilas, mesófilas, psicrófilas y psicrótrofas. Los microorganismos mesófilos, muchos de origen humano o animal incluyendo los patógenos y numerosos tipos de los que alteran los alimentos prefieren temperaturas moderadas; ofrecen un óptimo que generalmente se encuentra entre los 30 y 45º C y una temperatura mínima de crecimiento que suele hallarse entre 5 y 10º C. En un medio favorable, el tiempo de generación de muchos mesófilos a la temperatura óptima es de 0,5 horas, o aún menos. En los termófilos la totalidad de la gráfica que relaciona el crecimiento con la temperatura se halla desplazada hacia el rango de temperatura más alto. La temperatura para un crecimiento óptimo suele hallarse entre 55 y 65º C y en algunos casos es de hasta 75 – 90º C; la mínima se encuentra hacia los 35º C.

Todavía persiste cierta confusión con respecto al término psicrófilo. Utilizando los mismos criterios que nos han servido para definir los microorganismos mesófilos y termófilos, es lógico definir los psicrófilos en términos de su temperatura óptima de crecimiento, que debe ser claramente distinta de las de los dos citados grupos. Muchos autores, sin embargo, han clasificado como psicrófilos a todos aquellos microorganismos que son capaces de crecer a 0º C, sin tener en cuenta cual sea su temperatura óptima. Otros distinguen a los microorganismos que toleran las bajas temperaturas en psicrófilos obligados, con óptimos inferiores a 20º C y psicrófilos facultativos con temperaturas óptimas más altas. Los auténticos psicrófilos abundan en los ambientes fríos más de lo que al comienzo se pensaba, especialmente en aquellos lugares en los que se mantiene constantemente una temperatura baja. De hecho, el ambiente predominante de la biosfera es frío, dado que las regiones polares y los océanos (95 % en volumen por debajo de 5ºC) representan el 14 y el 71 % de la superficie del planeta, respectivamente (Morita, 1975). Al aislar psicrófilos es preciso cuidar de un modo especial de evitar la exposición a temperaturas superiores a 10ºC. Al olvido o al desconocimiento de este hecho se deben pasados fallos en la detección de un gran número de psicrófilos. En la Tecnología de los Alimentos los microorganismos psicrófilos son menos importantes que los psicrotrofos, en virtud de su mayor sensibilidad a las temperaturas elevadas. Los auténticos psicrófilos son generalmente de origen marino siendo en este hábitat en el que mayor interés cobran y comprenden solo unos pocos géneros.

A los microorganismos capaces de crecer en las proximidades de 0º C, pero que no reúnen los requisitos de temperaturas óptima y máxima para su clasificación como psicrófilos se les conoce como psicrótrofos. Como crecen mejor a temperaturas moderadas, pueden considerarse como un subgrupo de los mesófilos capaz de desarrollarse a temperaturas inferiores a la mínima tolerada por la mayoría de los mesófilos. Entre los psicrótrofos se incluyen bacterias Gram positivas y Gram negativas; aeróbicas, anaeróbicas, y anaeróbicas facultativas; carentes y provistas de movilidad; esporuladas y no esporuladas. El grupo comprende numerosas especies pertenecientes a no menos de 27 géneros. También se encuentran cepas psicrótrofas de levaduras y mohos pertenecientes a géneros tan importantes como Penicillium y Aspergillus. Temperaturas de refrigeración son aquellas próximas, pero superiores, al punto de congelación de los alimentos, habitualmente se consideran como tales las incluidas en el rango - 1 +7ºC. El efecto de la refrigeración sobre la microflora de un determinado alimento depende de la temperatura y el tiempo de almacenamiento, así como de las características fisiológicas de los microorganismos implicados. A medida que la temperatura desciende por debajo del óptimo, el crecimiento se hace más lento y finalmente se detiene. En el rango próximo a la temperatura de crecimiento, aumenta rápidamente la fase de latencia, tanto más cuanto más baja sea la temperatura, aproximándose finalmente a infinito. En el Ciadosprium herbanm, un hongo extremadamente tolerante a las bajas temperaturas, la fase de latencia oscila entre un día a la temperatura ambiente y 18 días a -5º C.
.jpg)
Se han citado periodos de latencia de hasta 414 días, pero es dudoso que a lo largo de un periodo tan prolongado se haya llevado un cuidadoso control de la temperatura. En el rango de temperaturas que permite tanto el crecimiento de los mesófilos típicos como el de los psicrotrofos la fase de latencia de estos últimos es mucho más corta. La velocidad de crecimiento se ve afectada por los cambios de temperatura; por debajo del óptimo, el crecimiento es más lento y en los rangos inferiores por debajo de 0º C) el tiempo de generación puede sobrepasar las cien horas. Las bajas temperaturas tienen una importante acción selectiva sobre las floras mixtas constituidas por mesófilos y psicrotrofos y pueden afectar a la composición de la carga inicial de un alimento determinado, además de conducir a modificaciones instanciales de la flora desarrollada a lo largo del tratamiento tecnológico o el almacenamiento. Así, por ejemplo, una carne vacuna refrigerada obtenida en un clima semitropical ofrece un periodo de vida útil, en condiciones de refrigeración, más largo que el de una carne similarmente tratada procedente de zonas más frías.

De acuerdo con la temperatura sobre la proporción de microorganismos tolerantes de las bajas temperaturas en la carga inicial procedente del suelo y la piel del animal; la carne de bóvido de las áreas mas frías tiene una proporción más elevada de psicrotrofos. La temperatura de almacenamiento ejerce una poderosa influencia sobre la microflora de la leche. La leche cruda mantenida a unos 10º C desarrolla una flora en la que dominan los estreptococos acidolácticos, en tanto que si es mantenida en las proximidades de 0º C la flora dominante está constituida principalmente por bacterias Gram negativas psicrotrofas. El enfriamiento rápido de las bacterias mesófilas, desde una temperatura normal de crecimiento hasta 0º C, causa la muerte o lesiona un cierto porcentaje de las células que componen el cultivo. Las bacterias Gram negativas, como Escherichia coli, Pseudomonas aeruginosas, P. fluorescens, diversas especies de Salmonella y Enterobacter aerogenes, parecen ser más susceptibles al frío que los microorganismos Gram positivos, aunque también se haya observado el shock del frío en Bacillus subtilis y Clostridium perfringens.

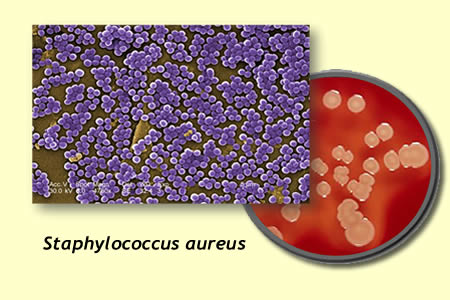
Staphylococcus aureus es resistente al shock del frío se observó que un cultivo de este microorganismo en caldo tripticasa soja incubado a 5º C, manifestó un incremento en la sensibilidad al agar manitol salado evidenciando así su lesión. Los microorganismos psicrotrofos parecen ser menos sensibles al frío. El crecimiento a temperaturas inferiores a la óptima puede provocar numerosas modificaciones morfológicas y fisiológicas de los microorganismos. Entre las modificaciones morfológicas cabe citar el incrementeo del tamaño celular en la levadura Candida utilis y en Escherichia coli, la formación de filamentos en E. coli, así como el deterioro de los mesosomas y la formación de doble pared celular en B. subtilis. El descenso diferencial de las actividades de los enzimas a bajas temperaturas puede alterar las rutas metabólicas y sus productos finales. Por ejemplo, los microorganismos que sintetizan pigmentos de fenacina y carotenoides tienden a rendir tasas más altas de estos productos a bajas temperaturas, lo que tiene cierta trascendencia en la alteración de los alimentos. La producción de dextranos extracelulares por Leuconostoc y pediococos se ve favorecida por las temperaturas inferiores a las óptimas de crecimiento de estas bacterias.

La producción de lipasa y proteinasa por Pseudomonas y otros géneros ocurre preferentemente a bajas temperaturas. Algunos de estos enzimas son termorresistentes y pueden persistir después del tratamiento térmico. Muchos de los procesos reguladores del metabolismo celular son sensibles a las temperaturas inferiores a la óptima, de modo que la exposición a las bajas temperaturas puede provocar desequilibrios metabólicos y el cese del crecimiento. La incubación a bajas temperaturas puede alterar igualmente la composición lipídica de las células microbianas. El contenido lipídico final de las bacterias es independiente de la temperatura de crecimiento, pero el de las levaduras aumenta ligeramente al descender la temperatura. Tanto las bacterias como las levaduras experimentan un incremento en la proporción de acidos grasos insaturados a medida que disminuyen las temperaturas de crecimiento; en las bacterias se producen además menos ácidos grasos que contienen el anillo del ciclopropano. También se han citado incrementos en la insaturación de los alcoholes de las ceras producidos por las cepas mesófilas de Acinetobacter crecidas a bajas temperaturas. El incremento de la proporción de ácidos grasos no saturados al descender la temperatura se cree esencial para que las membranas cumplan su función, dado que la alteración provocada desciende la temperatura a que los lípidos de la membrana "se congelan".
La proporción de ácidos grasos no saturados puede ser responsable de la capacidad de las células que soportan del frío, pero en los auxotrofos de. E coli para los ácidos grasos la distribución de estos en los lípidos de la membrana (siempre que en el medio de cultivo se hallen presentes tasas mínimas de ácidos grasos saturados y no saturados) puede variar dentro de amplios límites sin que aparentemente se vea afectada la capacidad del microorganismo para crecer a bajas temperaturas. Los alimentos pueden alterarse bajo la acción de microorganismos pertenecientes a los cuatro grupos en que se han clasificado en virtud de su respuesta a la temperatura: psicrofilos, mesófilos y psicrotrofos. Sin embargo, si los alimentos han sido refrigerados y mantenidos a las temperaturas de refrigeración adecuadas (inferiores a 7º C) la alteración sólo será causada por los psicrotrofos. Aunque los tiempos de generación de los psicrotrofos parezcan muy prolongados, los largos periodos de almacenamiento a refrigeración utilizados en muchos alimentos permiten que la población psicrotrófica alcance tasas de muchos millones por gramo en unos pocos días, lo que frecuentemente resulta en la aparición de alteraciones desagradables en el olor, el gusto y la textura. Deben evitarse las fluctuaciones en la temperatura de almacenamiento porque la velocidad de crecimiento aumenta rápidamente con ella.

La mayor parte de los patógenos son mesófilos y, con pocas excepciones, su crecimiento no constituye un problema en los alimentos refrigerados. Las salmonelas no crecen a temperaturas inferiores a unos 6º C y en un caldo rico la fase de latencia a 10º C de la S. typhimurium es de aproximadamente 12 horas y su tiempo de generación de unas 8 horas. El crecimiento en los alimentos puede ser mucho más lento. Así, por ejemplo, tanto la Salmonella senftenberg como la S. ententidis y la S. manhattan son incapaces de crecer a 10º C en ensalada de jamón o natillas, aunque crezcan a 7º C en pollo "a la King" Se observó que en carne de vaca picada y cruda, no crecían a 7º C inóculos de cinco serotipos de salmonella, multiplicándose, en cambio por 300 en cinco días a 12,5º C. Clostridium perfringens puede crecer a temperaturas entre 12 y 50º C, pero su desarrollo es muy lento por debajo de 15º C. Las células vegetativas del Clostridium perfringens son sensibles a las bajas temperaturas y el almacenamiento prolongado de los alimentos a temperaturas de refrigeración es probable que resulte en su destrucción lenta si las contienen. Los esporos no se ven afectados en el mismo grado por las acciones de las bajas temperaturas.

La velocidad de crecimiento se ve afectada además por el pH y la composición del medio, de modo que el crecimiento del C. perfingens es más lento en un medio a pH 5,8 que en otro de 7,2. Se ha observado también la germinación de esporos de clostridios a 5º C, es decir, por debajo de la temperatura mínima de crecimiento. Staphylococcus aureus es capaz de soportar las bajas temperaturas y de crecer hasta a unos 7º C , pero el límite inferior para la producción de toxinas es algo más elevado. Se han detectado, por ejemplo, enterotoxinas en alimentos mantenidos a 10º C pero por debajo de 20º C su producción es lenta. Alcanzar niveles detectables de toxina (1 mg/ml) a 13º C exigió en una cepa 158 horas. Otras cepas crecen a 13º C pero son incapaces de producir toxina a menos de 19º C. En un medio rico, a pH 7, el tiempo necesario para la producción de toxina en cantidades mensurables osciló en la cepa estudiada por Scheusner y col. (1973) entre 78 – 98 horas a 19º C y 14 – 16 horas a 26º C. Bajo condiciones menos favorables, la producción de toxina fue más lenta. Aunque se alcancen poblaciones abundantes de S. aureus, la producción de enterotoxina puede inhibirse mediante las acciones independientes e interactivas de la temperatura, el pH, la tensión de oxígeno, la actividad de agua y el desarrolo competitivo de otros microorganismos.
Vibrio parahaemolyticus es sensible a las bajas temperaturas y las intoxicaciones alimentarias producidas en Japón por este microorganismo suelen acaecer en los meses más cálidos del año. En la superficie del pescado marino al crecimiento parece cesar a temperaturas inferiores a 5 – 8ºC, aunque el microorganismo puede sobrevivir durante largos periodos de tiempo. El Vibrio parahaemolyticus puede multiplicarse hasta alcanzar niveles peligrosos al almacenar ostras a temperaturas de 10º C durante una semana. La temperatura de crecimiento más baja publicada para el V parahaemolyticus en medios de cultivo es de 5º C, pero el crecimiento a esta temperatura se ve fuertemente influido por el pH. Bacillus cereus crece en el rango de temperatura de 7º a 45º C y el Bacillus subtllis entre 12 y 55º C. No se han encontrado pruebas de que el E. coli enteropatógeno crezca a temperaturas inferiores a las mínimas de los demás E. coli. El número de E. coli enteropatógenos recuperables de los quesos blandos aumenta durante el almacenamiento a 4º C, pero no está claro en las experiencias en que se hizo esta observación si tal incremento era debido a la multiplicación del microorganismo o a la recuperación después del shock térmico. Se estudió el comportamiento de seis cepas de E. coli enteropatógeno en el queso Camembert a lo largo de un proceso de maduración de 7 semanas a 10º C y observaron un marcado descenso de las tasas de cuatro de ellas; en las otras dos las tasas aumentaron ligeramente durante la primera semana y decrecieron rápidamente en las seis restantes. Se han aislado microorganismos similares a la Yersinia enterocolitica en carne envasada a vacío y mantenida a 1 – 3º C y también se ha comprobado la producción de aflatoxina, oclaratoxina A y tremortinas A y B a 4 – 5ºC en diversos alimentos.
Las fermentaciones generalmente implicadas son la láctica y la alcohólica, o una combinación de ambas. Si el alimento original contiene un azúcar fermentescible y se encuentra moderadamente salado es probable que se produzca una fermentación láctica Si su sabor es ácido,lo esperable es una fermentación alcohólica. En cualquier caso, para conseguir las características deseadas en el producto fermentado de que se trate, resulta esencial el control de la temperatura, generalmente un ambiente frío. A lo largo de milenios de la historia de la humanidad, sólo las dos o tres últimas generaciones han sido capaces de capitalizar para la conservación y las fermentaciones de los alimentos los principios científicos en que estos procesos se basan. El control y la manipulación de la temperatura se encuentran entre los factores más críticos precisos para el logro de un suministro alimenticio que reúna las propiedades sanitarias organolépticas correctas. En este capítulo describiremos los principios científicos relacionados con la explotación de la temperatura en el control de los microorganismos que de ordinario pueden encontrarse en los alimentos consumidos por el hombre.
Probablemente sea la temperatura el más importante de los factores ambientales que afectan a la viabilidad y el desarrollo microbianos. Aunque el crecimiento microbiano es posible entre alrededor de -8 y hasta +90º C, el rango de temperatura que permite el desarrollo de un determinado microorganismo rara vez excede de los 37º C. Dentro de este rango, la temperatura afecta a la longitud de la fase de latencia, a la velocidad de crecimiento, al número final de células, a las necesidades nutritivas y a la composición química y enzimática de las células. Cualquier temperatura por encima de la máxima de crecimiento de un determinado microorganismo resulta letal para el mismo, y cuanto más elevada sea la temperatura en cuestión tanto más rápida será la pérdida de viabilidad. Sin embargo, la letalidad de cualquier exposición a una determinada temperatura por encima de la máxima de crecimiento depende de la termorresistencia que es fundamentalmente una característica del microorganismo considerado.
Los microorganismos sobreviven a temperaturas inferiores a la mínima de crecimiento. Los efectos letales de la refrigeración y la congelación dependen del germen considerado, del microambiente y de las condiciones de tiempo y temperatura de almacenamiento. Algunos microorganismos permanecen viables durante largos periodos de tiempo si se mantienen congelados a temperaturas suficientemente bajas. Tras un periodo de ajuste o adaptación al ambiente (fase de latencia) comienza el crecimiento que se acelera hasta alcanzar una etapa de multiplicación rápida y constante, de crecimiento exponencial, denominada fase logarítmica o exponencial. La defección de nutrientes y el acúmulo de metabolitos tóxicos termina frenando la velocidad de crecimiento hasta que alcanza un punto en el que muertes y divisiones celulares se igualan, permaneciendo así la población constante durante un periodo al que se conoce con el nombre de fase estacionaria. A esta fase en la que la población es máxima, sigue otra en la que va progresivamente decreciendo a causa de las muertes celulares. La influencia de la temperatura sobre la actividad microbiana es más acusada en los alimentos húmedos, es decir a actividades de agua (aw) superiores a 0,85. La mayor parte de las bacterias son incapaces de seguir creciendo a actividades de agua inferiores.
A las temperaturas más elevadas, hay un rango en el que la velocidad de crecimiento, tiempo de generación, se mantiene relativamente estable (óptimo de crecimiento); este rango se halla en torno a 20 – 30º C para los psicrótrofos y 35 – 45° C para los mesófilos. A temperaturas sólo ligeramente superiores a las que son precisas para un crecimiento óptimo se da una inhibición del mismo. Las bacterias termófilas responden de un modo similar, pero su gráfica de crecimiento se encuentra sustancialmente desplazada hacia la derecha. La naturaleza de la respuesta a cualquier temperatura dada se ve profundamente afectada por el tiempo de exposición a la misma. El crecimiento en un ambiente confinado, incluso a la temperatura óptima, cesa llegado un momento determinado a causa del gradual agotamiento de nutrientes. En atención a sus rangos de temperatura de crecimiento, pueden distinguirse cuatro grupos fisiológicos fundamentales de bacterias: termófilas, mesófilas, psicrófilas y psicrótrofas. Los microorganismos mesófilos, muchos de origen humano o animal incluyendo los patógenos y numerosos tipos de los que alteran los alimentos prefieren temperaturas moderadas; ofrecen un óptimo que generalmente se encuentra entre los 30 y 45º C y una temperatura mínima de crecimiento que suele hallarse entre 5 y 10º C. En un medio favorable, el tiempo de generación de muchos mesófilos a la temperatura óptima es de 0,5 horas, o aún menos. En los termófilos la totalidad de la gráfica que relaciona el crecimiento con la temperatura se halla desplazada hacia el rango de temperatura más alto. La temperatura para un crecimiento óptimo suele hallarse entre 55 y 65º C y en algunos casos es de hasta 75 – 90º C; la mínima se encuentra hacia los 35º C.
Todavía persiste cierta confusión con respecto al término psicrófilo. Utilizando los mismos criterios que nos han servido para definir los microorganismos mesófilos y termófilos, es lógico definir los psicrófilos en términos de su temperatura óptima de crecimiento, que debe ser claramente distinta de las de los dos citados grupos. Muchos autores, sin embargo, han clasificado como psicrófilos a todos aquellos microorganismos que son capaces de crecer a 0º C, sin tener en cuenta cual sea su temperatura óptima. Otros distinguen a los microorganismos que toleran las bajas temperaturas en psicrófilos obligados, con óptimos inferiores a 20º C y psicrófilos facultativos con temperaturas óptimas más altas. Los auténticos psicrófilos abundan en los ambientes fríos más de lo que al comienzo se pensaba, especialmente en aquellos lugares en los que se mantiene constantemente una temperatura baja. De hecho, el ambiente predominante de la biosfera es frío, dado que las regiones polares y los océanos (95 % en volumen por debajo de 5ºC) representan el 14 y el 71 % de la superficie del planeta, respectivamente (Morita, 1975). Al aislar psicrófilos es preciso cuidar de un modo especial de evitar la exposición a temperaturas superiores a 10ºC. Al olvido o al desconocimiento de este hecho se deben pasados fallos en la detección de un gran número de psicrófilos. En la Tecnología de los Alimentos los microorganismos psicrófilos son menos importantes que los psicrotrofos, en virtud de su mayor sensibilidad a las temperaturas elevadas. Los auténticos psicrófilos son generalmente de origen marino siendo en este hábitat en el que mayor interés cobran y comprenden solo unos pocos géneros.
A los microorganismos capaces de crecer en las proximidades de 0º C, pero que no reúnen los requisitos de temperaturas óptima y máxima para su clasificación como psicrófilos se les conoce como psicrótrofos. Como crecen mejor a temperaturas moderadas, pueden considerarse como un subgrupo de los mesófilos capaz de desarrollarse a temperaturas inferiores a la mínima tolerada por la mayoría de los mesófilos. Entre los psicrótrofos se incluyen bacterias Gram positivas y Gram negativas; aeróbicas, anaeróbicas, y anaeróbicas facultativas; carentes y provistas de movilidad; esporuladas y no esporuladas. El grupo comprende numerosas especies pertenecientes a no menos de 27 géneros. También se encuentran cepas psicrótrofas de levaduras y mohos pertenecientes a géneros tan importantes como Penicillium y Aspergillus. Temperaturas de refrigeración son aquellas próximas, pero superiores, al punto de congelación de los alimentos, habitualmente se consideran como tales las incluidas en el rango - 1 +7ºC. El efecto de la refrigeración sobre la microflora de un determinado alimento depende de la temperatura y el tiempo de almacenamiento, así como de las características fisiológicas de los microorganismos implicados. A medida que la temperatura desciende por debajo del óptimo, el crecimiento se hace más lento y finalmente se detiene. En el rango próximo a la temperatura de crecimiento, aumenta rápidamente la fase de latencia, tanto más cuanto más baja sea la temperatura, aproximándose finalmente a infinito. En el Ciadosprium herbanm, un hongo extremadamente tolerante a las bajas temperaturas, la fase de latencia oscila entre un día a la temperatura ambiente y 18 días a -5º C.
.jpg)
Se han citado periodos de latencia de hasta 414 días, pero es dudoso que a lo largo de un periodo tan prolongado se haya llevado un cuidadoso control de la temperatura. En el rango de temperaturas que permite tanto el crecimiento de los mesófilos típicos como el de los psicrotrofos la fase de latencia de estos últimos es mucho más corta. La velocidad de crecimiento se ve afectada por los cambios de temperatura; por debajo del óptimo, el crecimiento es más lento y en los rangos inferiores por debajo de 0º C) el tiempo de generación puede sobrepasar las cien horas. Las bajas temperaturas tienen una importante acción selectiva sobre las floras mixtas constituidas por mesófilos y psicrotrofos y pueden afectar a la composición de la carga inicial de un alimento determinado, además de conducir a modificaciones instanciales de la flora desarrollada a lo largo del tratamiento tecnológico o el almacenamiento. Así, por ejemplo, una carne vacuna refrigerada obtenida en un clima semitropical ofrece un periodo de vida útil, en condiciones de refrigeración, más largo que el de una carne similarmente tratada procedente de zonas más frías.
De acuerdo con la temperatura sobre la proporción de microorganismos tolerantes de las bajas temperaturas en la carga inicial procedente del suelo y la piel del animal; la carne de bóvido de las áreas mas frías tiene una proporción más elevada de psicrotrofos. La temperatura de almacenamiento ejerce una poderosa influencia sobre la microflora de la leche. La leche cruda mantenida a unos 10º C desarrolla una flora en la que dominan los estreptococos acidolácticos, en tanto que si es mantenida en las proximidades de 0º C la flora dominante está constituida principalmente por bacterias Gram negativas psicrotrofas. El enfriamiento rápido de las bacterias mesófilas, desde una temperatura normal de crecimiento hasta 0º C, causa la muerte o lesiona un cierto porcentaje de las células que componen el cultivo. Las bacterias Gram negativas, como Escherichia coli, Pseudomonas aeruginosas, P. fluorescens, diversas especies de Salmonella y Enterobacter aerogenes, parecen ser más susceptibles al frío que los microorganismos Gram positivos, aunque también se haya observado el shock del frío en Bacillus subtilis y Clostridium perfringens.
Staphylococcus aureus es resistente al shock del frío se observó que un cultivo de este microorganismo en caldo tripticasa soja incubado a 5º C, manifestó un incremento en la sensibilidad al agar manitol salado evidenciando así su lesión. Los microorganismos psicrotrofos parecen ser menos sensibles al frío. El crecimiento a temperaturas inferiores a la óptima puede provocar numerosas modificaciones morfológicas y fisiológicas de los microorganismos. Entre las modificaciones morfológicas cabe citar el incrementeo del tamaño celular en la levadura Candida utilis y en Escherichia coli, la formación de filamentos en E. coli, así como el deterioro de los mesosomas y la formación de doble pared celular en B. subtilis. El descenso diferencial de las actividades de los enzimas a bajas temperaturas puede alterar las rutas metabólicas y sus productos finales. Por ejemplo, los microorganismos que sintetizan pigmentos de fenacina y carotenoides tienden a rendir tasas más altas de estos productos a bajas temperaturas, lo que tiene cierta trascendencia en la alteración de los alimentos. La producción de dextranos extracelulares por Leuconostoc y pediococos se ve favorecida por las temperaturas inferiores a las óptimas de crecimiento de estas bacterias.
La producción de lipasa y proteinasa por Pseudomonas y otros géneros ocurre preferentemente a bajas temperaturas. Algunos de estos enzimas son termorresistentes y pueden persistir después del tratamiento térmico. Muchos de los procesos reguladores del metabolismo celular son sensibles a las temperaturas inferiores a la óptima, de modo que la exposición a las bajas temperaturas puede provocar desequilibrios metabólicos y el cese del crecimiento. La incubación a bajas temperaturas puede alterar igualmente la composición lipídica de las células microbianas. El contenido lipídico final de las bacterias es independiente de la temperatura de crecimiento, pero el de las levaduras aumenta ligeramente al descender la temperatura. Tanto las bacterias como las levaduras experimentan un incremento en la proporción de acidos grasos insaturados a medida que disminuyen las temperaturas de crecimiento; en las bacterias se producen además menos ácidos grasos que contienen el anillo del ciclopropano. También se han citado incrementos en la insaturación de los alcoholes de las ceras producidos por las cepas mesófilas de Acinetobacter crecidas a bajas temperaturas. El incremento de la proporción de ácidos grasos no saturados al descender la temperatura se cree esencial para que las membranas cumplan su función, dado que la alteración provocada desciende la temperatura a que los lípidos de la membrana "se congelan".
La proporción de ácidos grasos no saturados puede ser responsable de la capacidad de las células que soportan del frío, pero en los auxotrofos de. E coli para los ácidos grasos la distribución de estos en los lípidos de la membrana (siempre que en el medio de cultivo se hallen presentes tasas mínimas de ácidos grasos saturados y no saturados) puede variar dentro de amplios límites sin que aparentemente se vea afectada la capacidad del microorganismo para crecer a bajas temperaturas. Los alimentos pueden alterarse bajo la acción de microorganismos pertenecientes a los cuatro grupos en que se han clasificado en virtud de su respuesta a la temperatura: psicrofilos, mesófilos y psicrotrofos. Sin embargo, si los alimentos han sido refrigerados y mantenidos a las temperaturas de refrigeración adecuadas (inferiores a 7º C) la alteración sólo será causada por los psicrotrofos. Aunque los tiempos de generación de los psicrotrofos parezcan muy prolongados, los largos periodos de almacenamiento a refrigeración utilizados en muchos alimentos permiten que la población psicrotrófica alcance tasas de muchos millones por gramo en unos pocos días, lo que frecuentemente resulta en la aparición de alteraciones desagradables en el olor, el gusto y la textura. Deben evitarse las fluctuaciones en la temperatura de almacenamiento porque la velocidad de crecimiento aumenta rápidamente con ella.
La mayor parte de los patógenos son mesófilos y, con pocas excepciones, su crecimiento no constituye un problema en los alimentos refrigerados. Las salmonelas no crecen a temperaturas inferiores a unos 6º C y en un caldo rico la fase de latencia a 10º C de la S. typhimurium es de aproximadamente 12 horas y su tiempo de generación de unas 8 horas. El crecimiento en los alimentos puede ser mucho más lento. Así, por ejemplo, tanto la Salmonella senftenberg como la S. ententidis y la S. manhattan son incapaces de crecer a 10º C en ensalada de jamón o natillas, aunque crezcan a 7º C en pollo "a la King" Se observó que en carne de vaca picada y cruda, no crecían a 7º C inóculos de cinco serotipos de salmonella, multiplicándose, en cambio por 300 en cinco días a 12,5º C. Clostridium perfringens puede crecer a temperaturas entre 12 y 50º C, pero su desarrollo es muy lento por debajo de 15º C. Las células vegetativas del Clostridium perfringens son sensibles a las bajas temperaturas y el almacenamiento prolongado de los alimentos a temperaturas de refrigeración es probable que resulte en su destrucción lenta si las contienen. Los esporos no se ven afectados en el mismo grado por las acciones de las bajas temperaturas.
La velocidad de crecimiento se ve afectada además por el pH y la composición del medio, de modo que el crecimiento del C. perfingens es más lento en un medio a pH 5,8 que en otro de 7,2. Se ha observado también la germinación de esporos de clostridios a 5º C, es decir, por debajo de la temperatura mínima de crecimiento. Staphylococcus aureus es capaz de soportar las bajas temperaturas y de crecer hasta a unos 7º C , pero el límite inferior para la producción de toxinas es algo más elevado. Se han detectado, por ejemplo, enterotoxinas en alimentos mantenidos a 10º C pero por debajo de 20º C su producción es lenta. Alcanzar niveles detectables de toxina (1 mg/ml) a 13º C exigió en una cepa 158 horas. Otras cepas crecen a 13º C pero son incapaces de producir toxina a menos de 19º C. En un medio rico, a pH 7, el tiempo necesario para la producción de toxina en cantidades mensurables osciló en la cepa estudiada por Scheusner y col. (1973) entre 78 – 98 horas a 19º C y 14 – 16 horas a 26º C. Bajo condiciones menos favorables, la producción de toxina fue más lenta. Aunque se alcancen poblaciones abundantes de S. aureus, la producción de enterotoxina puede inhibirse mediante las acciones independientes e interactivas de la temperatura, el pH, la tensión de oxígeno, la actividad de agua y el desarrolo competitivo de otros microorganismos.

Vibrio parahaemolyticus es sensible a las bajas temperaturas y las intoxicaciones alimentarias producidas en Japón por este microorganismo suelen acaecer en los meses más cálidos del año. En la superficie del pescado marino al crecimiento parece cesar a temperaturas inferiores a 5 – 8ºC, aunque el microorganismo puede sobrevivir durante largos periodos de tiempo. El Vibrio parahaemolyticus puede multiplicarse hasta alcanzar niveles peligrosos al almacenar ostras a temperaturas de 10º C durante una semana. La temperatura de crecimiento más baja publicada para el V parahaemolyticus en medios de cultivo es de 5º C, pero el crecimiento a esta temperatura se ve fuertemente influido por el pH. Bacillus cereus crece en el rango de temperatura de 7º a 45º C y el Bacillus subtllis entre 12 y 55º C. No se han encontrado pruebas de que el E. coli enteropatógeno crezca a temperaturas inferiores a las mínimas de los demás E. coli. El número de E. coli enteropatógenos recuperables de los quesos blandos aumenta durante el almacenamiento a 4º C, pero no está claro en las experiencias en que se hizo esta observación si tal incremento era debido a la multiplicación del microorganismo o a la recuperación después del shock térmico. Se estudió el comportamiento de seis cepas de E. coli enteropatógeno en el queso Camembert a lo largo de un proceso de maduración de 7 semanas a 10º C y observaron un marcado descenso de las tasas de cuatro de ellas; en las otras dos las tasas aumentaron ligeramente durante la primera semana y decrecieron rápidamente en las seis restantes. Se han aislado microorganismos similares a la Yersinia enterocolitica en carne envasada a vacío y mantenida a 1 – 3º C y también se ha comprobado la producción de aflatoxina, oclaratoxina A y tremortinas A y B a 4 – 5ºC en diversos alimentos.
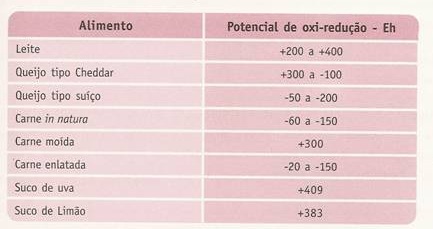
g. POTENCIAL DE OXIDACIÓN – REDUCCIÓN O POTENCIAL REDOX
Mientras
que el pH de los alimentos se mide con facilidad y se comprende la
significación de su medida, mucho más difícil resulta medir la repetibilidad
del potencial de oxidación – reducción (Potencial Redox), sobre todo entre
laboratorios diferentes, y además no está clara la significación que en la
microbiología del producto tienen los valores hallados. Se piensa que el
potencial redox es un importante factor selectivo en todos los ambientes,
incluidos los alimentos, que probablemente influye en los tipos de
microorganismos presentes y en su metabolismo. Las diferencias observadas en
los productos finales del metabolismo, discernibles por el consumidor por
diferencias de color o sabor, pueden ser en algunos casos la consecuencia de
diferencias redox. En
los alimentos picados (productos cárnicos) o en los productos no homogéneos
(emulsiones), el potencial redox puede variar considerablemente de una parte a
otra debido a altas concentraciones localizadas de diversos pares redox o de
nutrientes como glucosa, fumarato o malato. Cuando se encuentra restringida la
difusión gaseosa hacia el centro del alimento pueden existir gradientes de
potencial redox desde la atmósfera hasta las partes profundas del
alimento.
El potencial redox indica las relaciones de oxígeno de los microorganismos vivos y puede ser utilizado para especificar el ambiente en que un microorganismo es capaz de generar energía y sintetizar nuevas células sin recurrir al oxígeno molecular. Los microorganismos aerobios necesitan para crecer valores redox positivos mientras que los anaerobios frecuentemente requieren valores redox negativos. En diferentes cultivos microbianos el valor redox puede oscilar dentro de un rango comprendido entre una cifra anaeróbica inferior a unos -420 milivoltios (mV) hasta una cifra aeróbica de aproximadamente +300 mV. Los procesos de oxidación y de reducción se definen en términos de migraciones electrónicas entre compuestos químicos. La oxidación es la pérdida de electrones mientras que la reducción es la ganancia de electrones. Cuando se oxida una sustancia (libera electrones) siempre se reduce simultáneamente otra (o sea, capta los electrones liberados). Este concepto electrónico ha sugerido el desarrollo de métodos para estudiar cuantitativamente los procesos de oxidación-reducción reversibles que son vitales para las células vivas. La medida del potencial de electrodo permite determinar el grado de reducción o de oxidación de una sustancia alimenticia determinada. Esta medida sugiere la posibilidad de clasificar los sistemas oxidantes y reductores de los alimentos en base a su intensidad.
El potencial redox indica las relaciones de oxígeno de los microorganismos vivos y puede ser utilizado para especificar el ambiente en que un microorganismo es capaz de generar energía y sintetizar nuevas células sin recurrir al oxígeno molecular. Los microorganismos aerobios necesitan para crecer valores redox positivos mientras que los anaerobios frecuentemente requieren valores redox negativos. En diferentes cultivos microbianos el valor redox puede oscilar dentro de un rango comprendido entre una cifra anaeróbica inferior a unos -420 milivoltios (mV) hasta una cifra aeróbica de aproximadamente +300 mV. Los procesos de oxidación y de reducción se definen en términos de migraciones electrónicas entre compuestos químicos. La oxidación es la pérdida de electrones mientras que la reducción es la ganancia de electrones. Cuando se oxida una sustancia (libera electrones) siempre se reduce simultáneamente otra (o sea, capta los electrones liberados). Este concepto electrónico ha sugerido el desarrollo de métodos para estudiar cuantitativamente los procesos de oxidación-reducción reversibles que son vitales para las células vivas. La medida del potencial de electrodo permite determinar el grado de reducción o de oxidación de una sustancia alimenticia determinada. Esta medida sugiere la posibilidad de clasificar los sistemas oxidantes y reductores de los alimentos en base a su intensidad.

Todo
proceso redox reversible puede expresarse así:
[oxidante]
+ [H+] + ne = [reductor]
expresión
en la que ne es el número de electrones transferidos en el
proceso. El potencial redox (Eh) de tal proceso viene dado por la ecuación
concebida y desarrollada originalmente por Nernst (Pirt, 1975):
Eh =
Eo + (RT/nF) ln [oxidante]/[reductor]
en la
que Eo es el potencial redox estándar a pH 0 pero en presencia
de otros solutos a concentración 1 M (normalmente se mide como el potencial
redox del punto medio a pH 0 y se supone que su valor es igual al valor teórico
de los pares redox en solución acuosa diluida), R es la constante del
gas molar, T la temperatura en ºK, F la cantidad Faraday de
electricidad, n el número de electrones transferidos en el proceso y ln
el logaritmo natural. En muchos alimentos es difícil obtener la verdadera
medida del potencial redox. Para que el potencial redox de una muestra
represente fielmente el del alimento de que fue tomada es esencial que se
mantenga inalterado el ambiente gaseoso tanto si el alimento está envasado a
vacío, envasado bajo una atmósfera anóxica o envasado en contacto con el aire.
Puesto que el potencial redox desciende a consecuencia de la actividad
metabólica, el transporte de la muestra deberá realizarse bien en condiciones
de refrigeración (0 – 4º C) o a la temperatura de almacenamiento del alimento. La temperatura. y
el tiempo del transporte deberán especificarse para ser consideradas en la
interpretación de los resultados. El oxígeno es el principal agente que
interfiere la medida del potencial redox. En general no deben usarse en la
determinación del potencial redox muestras extraídas porque el oxígeno puede
penetrar en la muestra durante el muestreo. Para evitar que el oxígeno
contamine las muestras deberá quitarse la capa superior de la muestra de
alimento bajo gas inerte para efectuar la medida.

Puesto que los valores de potencial medidos dependen del pH, cada medida de potencial redox deberá ir acompañada de la medida del pH. El pH puede cambiar el potencial redox real, pero también para el mismo valor Eh el pH puede crear condiciones favorecedoras de diferentes tipos de metabolismo. Se ha demostrado la influencia del pH sobre el potencial redox limitante del crecimiento del Clostridium perfringens. El concepto de rH se introdujo para eliminar por cálculo ésta dependencia del pH. Mientras que el rH puede calcularse exactamente cuando todos los iones hidrógeno están completamente disociados a todos los valores pH, cuando el grado de disociación es alterado por el pH se producen inexactitudes. Además, los ácidos monovalentes alteran el potencial redox 30 mV por unidad pH, los ácidos divalentes 57,7 mV y los ácidos de valencia superior hasta 120 mV. Para convertir el Eh (en voltios) en rH puede usarse la siguiente fórmula:
Puesto que los valores de potencial medidos dependen del pH, cada medida de potencial redox deberá ir acompañada de la medida del pH. El pH puede cambiar el potencial redox real, pero también para el mismo valor Eh el pH puede crear condiciones favorecedoras de diferentes tipos de metabolismo. Se ha demostrado la influencia del pH sobre el potencial redox limitante del crecimiento del Clostridium perfringens. El concepto de rH se introdujo para eliminar por cálculo ésta dependencia del pH. Mientras que el rH puede calcularse exactamente cuando todos los iones hidrógeno están completamente disociados a todos los valores pH, cuando el grado de disociación es alterado por el pH se producen inexactitudes. Además, los ácidos monovalentes alteran el potencial redox 30 mV por unidad pH, los ácidos divalentes 57,7 mV y los ácidos de valencia superior hasta 120 mV. Para convertir el Eh (en voltios) en rH puede usarse la siguiente fórmula:
Eh =
0,03 (rH - 2 · pH) o rH = Eh / 0,03 + 2 · pH
El
potencial redox se mide con un electrodo de metal inerte (normalmente platino)
en un circuito con un electrodo de referencia. Alternativamente pueden
utilizarse colorantes que cambian de color a determinados potenciales redox si
bien estos indicadores pueden interactuar con los microorganismos y los
alimentos obteniéndose falsos valores. El electrodo de
platino responderá a cualquier sistema que produzca una reacción
electroquimicamente reversible en la superficie del electrodo, siempre que la
velocidad de reacción sea rápida en comparación con la captura o liberación de
electrones del electrodo medidor. Con los modernos sistemas de medida de alta
impedancia (1013 ohmios) pueden medirse potenciales verdaderos
a partir de pares redox que producen corrientes de cambio muy bajo. En los
sistemas que reaccionan con relativa rapidez tales como el Fe2+/Fe3+ pueden
obtenerse medidas cuando la concentración del par es tan baja como 10-5 M.
La calibración de electrodos redox está relacionada teóricamente al electrodo
de hidrógeno estandar, aunque en la práctica se usa un electrodo de calomelano
u otro tipo de electrodo de referencia. Para la medida
potenciométrica del potencial redox de muestras de alimentos líquidos se usan
los electrodos de platino estandar y de calomelano. Para medidas sobre
alimentos sólidos se necesita utilizar electrodos especiales con punta de
platino afilada, que tengan escaso diámetro y gruesa pared y puentes de
CIK-agar en tubos con punta rellena de fibras de asbestos fundido. A diferencia
de los electrodos de pH, los electrodos redox requieren cierto tiempo
(dependiente del tipo de muestra) para revelar el potencial redox.

El potencial redox de los alimentos depende de las cantidades relativas de sustancias oxidadas y reducidas que contengan. Los alimentos que tienen grandes cantidades de tales sustancias son resistentes a los cambios del potencial redox y se llaman "fuertemente tamponados". De aquí que no sea fácil la interpretación de la lectura arrojada por un electrodo redox insertado en un alimento, puesto que el alimento puede estar o no fuertemente tamponado. En los alimentos débilmente tamponados una pequeña población microbiana (< 105/g) posiblemente puede causar un cambio del potencial redox, mientras que en los alimentos fuertemente tamponados una población microbiana grande (> 108/g) apenas puede afectar al potencial redox. Para poder juzgar la significación de cualquier cambio del potencial redox de un alimento hay que tener en cuenta el potencial metabólico y el tamaño de la población microbiana en relación con la capacidad tampón redox del alimento. Las medidas redox tienen la máxima utilidad cuando existen pares reversibles de componentes conocidos que se encuentran en equilibrio. Todo alimento puede contener pares redox pero algunos no se encuentran en equilibrio y otros son irreversibles. Se ha sugerido que la sonda redox puede ser un monitor adecuado de alteraciones o cambios deseables durante el almacenamiento de alimentos envasados a vacío, bajo atmósferas de gas anóxico o enlatados. Se ha visto que indica con exactitud tales cambios profundos en la carne en postrigor, donde se encuentran relaciones empíricas reproducibles entre los eventos metabólicos y el potencial redox.

En tales circunstancias los principales sustratos o productos microbianos muestran alta actividad con el electrodo y pueden enmascarar todas las reacciones colaterales o interferentes de forma tal que el potencial redox medido es la verdadera representación del estado del par redox dominante. En presencia de oxígeno todos los pares redox de los alimentos tienden hacia el estado totalmente oxidado. Aunque el oxígeno disuelto no influye en la sonda de platino en presencia de agua pura, en presencia de soluciones salinas (incluyendo alimentos tales como el jamón y las verduras encurtidas) se producen reacciones electrolíticas que pueden sensibilizar la sonda al oxígeno disuelto haciendo que indique valores redox artificialmente altos positivos). En tales circunstancias el potencial redox aparente será función del logaritmo de la concentración del oxígeno disuelto y por tanto grandes cambios del potencial redox representarán pequeños cambios de la tensión del oxígeno disuelto. Jacob (1970) señaló una caída de 60 mV por el 90 % de reducción de la concentración del oxígeno disuelto. A tensiones de oxígeno disuelto muy bajas las sondas redox pueden exhibir relaciones empíricas entre el oxígeno y los cambios metabólicos. Sin embargo, a estos bajos niveles de oxígeno la bioquímica de los microorganismos y los alimentos bioquímicamente activos sufren cambios metabólicos que alteran de forma impredecible estas relaciones.

El potencial redox y el pH se pueden controlar en los medios de cultivo, y probablemente en los alimentos, ajustando la concentración de O2 gaseoso y CO2 del espacio de cabeza existente sobre el medio. Aunque en teoría puede alcanzarse un equilibrio estable entre las concentraciones en las fases de gas y de agua (relativas a la solubilidad de los gases en el medio de cultivo y la temperatura), la captación de O2 y la liberación de CO2 por los cultivos microbianos excederá con frecuencia de tales concentraciones. El potencial redox puede reducirse rápidamente durante la germinación y crecimiento de los esporos puesto que, aunque inicialmente sólo germina una pequeña proporción de los esporos, los esporos que germinan y crecen producen nicotinamida adenín dinucleótido reducido (NADH) y otros reductores que reducen la concentración de oxígeno a un nivel no inhibidor para los esporos remanentes. Esta reducción del nivel de oxígeno y la mayor tensión de H2 producida por el metabolismo celular se traduce en una gran caída del potencial redox. Los ambientes creados en los alimentos pueden categorizarse a groso modo como aquellos en los que el acceso de oxígeno está restringido y en los que no está restringido.
En los que el acceso de oxígeno es limitado los microbios que se desarrollan producen CO2 + H2O como principales productos finales; aunque la producción de productos finales tales como ácidos orgánicos no es significativa, entre los metabolitos secundarlos pueden incluirse aminas, etc. Cuando el acceso al oxígeno es restringido ocurre la fermentación y pueden impartirse cambios de aroma al alimento antes de que se altere. Antes de que tales cambios sean detectables por el consumidor tiene que alcanzarse un alto número de microorganismos (> 106 /gm). Algunos microorganismos, como los aerobios estrictos y los anaerobios, sólo poseen un sistema metabólico terminal para obtener energía y en consecuencia solamente son activos dentro de un margen de potencial redox relativamente estrecho. Otros, como los anaerobios facultativos, tienen sistemas alternativos que pueden ser puestos en marcha o paro por el potencial redox o la presencia o ausencia de oxígeno.
El potencial redox de los alimentos depende de las cantidades relativas de sustancias oxidadas y reducidas que contengan. Los alimentos que tienen grandes cantidades de tales sustancias son resistentes a los cambios del potencial redox y se llaman "fuertemente tamponados". De aquí que no sea fácil la interpretación de la lectura arrojada por un electrodo redox insertado en un alimento, puesto que el alimento puede estar o no fuertemente tamponado. En los alimentos débilmente tamponados una pequeña población microbiana (< 105/g) posiblemente puede causar un cambio del potencial redox, mientras que en los alimentos fuertemente tamponados una población microbiana grande (> 108/g) apenas puede afectar al potencial redox. Para poder juzgar la significación de cualquier cambio del potencial redox de un alimento hay que tener en cuenta el potencial metabólico y el tamaño de la población microbiana en relación con la capacidad tampón redox del alimento. Las medidas redox tienen la máxima utilidad cuando existen pares reversibles de componentes conocidos que se encuentran en equilibrio. Todo alimento puede contener pares redox pero algunos no se encuentran en equilibrio y otros son irreversibles. Se ha sugerido que la sonda redox puede ser un monitor adecuado de alteraciones o cambios deseables durante el almacenamiento de alimentos envasados a vacío, bajo atmósferas de gas anóxico o enlatados. Se ha visto que indica con exactitud tales cambios profundos en la carne en postrigor, donde se encuentran relaciones empíricas reproducibles entre los eventos metabólicos y el potencial redox.
En tales circunstancias los principales sustratos o productos microbianos muestran alta actividad con el electrodo y pueden enmascarar todas las reacciones colaterales o interferentes de forma tal que el potencial redox medido es la verdadera representación del estado del par redox dominante. En presencia de oxígeno todos los pares redox de los alimentos tienden hacia el estado totalmente oxidado. Aunque el oxígeno disuelto no influye en la sonda de platino en presencia de agua pura, en presencia de soluciones salinas (incluyendo alimentos tales como el jamón y las verduras encurtidas) se producen reacciones electrolíticas que pueden sensibilizar la sonda al oxígeno disuelto haciendo que indique valores redox artificialmente altos positivos). En tales circunstancias el potencial redox aparente será función del logaritmo de la concentración del oxígeno disuelto y por tanto grandes cambios del potencial redox representarán pequeños cambios de la tensión del oxígeno disuelto. Jacob (1970) señaló una caída de 60 mV por el 90 % de reducción de la concentración del oxígeno disuelto. A tensiones de oxígeno disuelto muy bajas las sondas redox pueden exhibir relaciones empíricas entre el oxígeno y los cambios metabólicos. Sin embargo, a estos bajos niveles de oxígeno la bioquímica de los microorganismos y los alimentos bioquímicamente activos sufren cambios metabólicos que alteran de forma impredecible estas relaciones.
El potencial redox y el pH se pueden controlar en los medios de cultivo, y probablemente en los alimentos, ajustando la concentración de O2 gaseoso y CO2 del espacio de cabeza existente sobre el medio. Aunque en teoría puede alcanzarse un equilibrio estable entre las concentraciones en las fases de gas y de agua (relativas a la solubilidad de los gases en el medio de cultivo y la temperatura), la captación de O2 y la liberación de CO2 por los cultivos microbianos excederá con frecuencia de tales concentraciones. El potencial redox puede reducirse rápidamente durante la germinación y crecimiento de los esporos puesto que, aunque inicialmente sólo germina una pequeña proporción de los esporos, los esporos que germinan y crecen producen nicotinamida adenín dinucleótido reducido (NADH) y otros reductores que reducen la concentración de oxígeno a un nivel no inhibidor para los esporos remanentes. Esta reducción del nivel de oxígeno y la mayor tensión de H2 producida por el metabolismo celular se traduce en una gran caída del potencial redox. Los ambientes creados en los alimentos pueden categorizarse a groso modo como aquellos en los que el acceso de oxígeno está restringido y en los que no está restringido.

En los que el acceso de oxígeno es limitado los microbios que se desarrollan producen CO2 + H2O como principales productos finales; aunque la producción de productos finales tales como ácidos orgánicos no es significativa, entre los metabolitos secundarlos pueden incluirse aminas, etc. Cuando el acceso al oxígeno es restringido ocurre la fermentación y pueden impartirse cambios de aroma al alimento antes de que se altere. Antes de que tales cambios sean detectables por el consumidor tiene que alcanzarse un alto número de microorganismos (> 106 /gm). Algunos microorganismos, como los aerobios estrictos y los anaerobios, sólo poseen un sistema metabólico terminal para obtener energía y en consecuencia solamente son activos dentro de un margen de potencial redox relativamente estrecho. Otros, como los anaerobios facultativos, tienen sistemas alternativos que pueden ser puestos en marcha o paro por el potencial redox o la presencia o ausencia de oxígeno.

"SOMOS LO QUE HACEMOS REPETIDAMENTE. EXCELENCIA, POR LO TANTO, NO ES UN ACTO SINO UN HÁBITO"
ARISTOTELES
LEGALES: El autor no asume responsabilidad alguna por la descarga, copia, distribución, modificación o alteración de los contenidos publicados, sean propios del mismo o de terceros, los cuales pudieren estar protegidos por Copyright, Derechos de Propiedad Intelectual, Derechos de Autor, o relacionados. La Bibliografía del tema expuesto y el crédito fotográfico está en poder del Autor y no se publica dada su extensión, pero se enviará por mail al interesado que la solicitare debidamente fundamentada.



Comentarios
Publicar un comentario