ENFERMEDADES TRANSMITIDAS por los ALIMENTOS - Revisión (Parte 19)
"La duda es uno de los muchos nombres de la inteligencia"
Jorge Luis Borges
ENFERMEDADES TRANSMITIDAS por los ALIMENTOS - Revisión
(Parte 19)

ESCOMBROTOXINA







































ESCOMBROTOXINA

El
envenenamiento escromboide o por escombrotoxina, es causado por la ingestión de
alimentos que contienen altos niveles de histamina y posiblemente otras aminas
y compuestos vasoactivos. La histamina y las otras aminas se forman por el
crecimiento de ciertas bacterias y la consecuente acción de sus enzimas
descarboxilasas en la histidina y en otros aminoácidos en los alimentos, ya sea
durante su producción como es el caso del queso suizo o por que se dé un
deterioro de los alimentos tal como productos de pescado, particularmente de atún.
Sin embargo, cualquier alimento que contenga los aminoácidos adecuados y que
sea sujeto a cierta contaminación y crecimiento bacteriano, puede dar lugar a
un envenenamiento escromboide cuando se consuma. La intoxicación por
escombroides generalmente ocurre en peces llamados azules o de carne oscura
como el atún, la caballa y el bonito. Dado que este tóxico se desarrolla
después de que el pez es capturado y muere, el lugar donde haya sido pescado
realmente no importa. El principal factor es por cuánto tiempo el pescado
permanece al aire libre sin ser refrigerado ni congelado. Los síntomas
iniciales pueden incluir sensaciones de hormigueo o picazón en la boca,
erupciones en la parte superior del cuerpo y un descenso en la presión
sanguínea.
Frecuentemente,
también produce dolor de cabeza y picor de la piel. Los síntomas pueden
progresar hasta nauseas, vómitos y diarrea y puede requerir hospitalización,
particularmente en el caso de pacientes de edad avanzada o enfermos. Los
síntomas de la intoxicación comienzan rápidamente, en un rango desde
inmediatamente hasta unos 30 minutos. La duración de la enfermedad es
normalmente de 3 horas, pero puede durar varios días. El diagnóstico de la
enfermedad normalmente se basa en los síntomas del paciente, el tiempo de
comienzo y el efecto del tratamiento con medicación antihistamínica. El
alimento sospechoso debe ser analizado a las pocas horas en busca de altos
niveles de histamina para confirmar el diagnóstico. Entre los productos
piscícolas que están implicados en el envenenamiento escómbrico se incluyen los
túnidos (por ejemplo el bonito y el atún claro), el delfín dorado, anjova,
sardinas, caballa, serviola y abalón. Muchos otros productos han causado
también los efectos tóxicos. El queso más extendido que más intoxicaciones
causa es el queso suizo. Las toxinas se forman en un alimento cuando ciertas
bacterias están presentes y el tiempo y la temperatura permiten su crecimiento.
La distribución de las toxinas dentro de un filete de pescado individual o
entre latas en un lote completo puede ser irregular, por lo tanto unas
secciones del producto causarían la enfermedad y otras no. Ni el cocinado, ni
el enlatado, ni el congelado reducen el efecto tóxico.
El
examen sensorial del consumidor no puede asegurar la ausencia o presencia de la
toxina. Las pruebas químicas son la única manera fiable para la evaluación de
un producto. Por lo tanto todos los pescados que no estén frescos, o que estén
mal conservados pueden contener histamina o productos relacionados.
Afortunadamente, la producción de histamina, pero no siempre, se correlaciona
con la producción de amoniaco, lo que resulta en un deterioro visible o en mal
olor. Todos los humanos son susceptibles al envenenamiento escromboide; sin
embargo, los síntomas pueden ser severos para las personas mayores y para
aquellos que estén tomando medicación del tipo de isoniazida. Dada la red
mundial de crianza, procesado y distribución de productos piscícolas, el impacto
del problema no está limitado a áreas geográficas específicas o a un patrón de
consumo.
La
histamina es un compuesto de presencia normal en el organismo que se forma a
partir de la descarboxilación del aminoácido L-histidina. Es sintetizada y
almacenada en células especializadas, principalmente mastocitos (células
sub-epiteliales de los tejidos) y basófilos de la sangre, que regulan su
liberación de acuerdo a la necesidad. Debido al comportamiento de su anillo
imidazólico que se encuentra ionizado a pH fisiológico, la histamina resulta
implicada en actividades biológicas normales y subnormales siendo un mensajero
químico que media un amplio rango de respuestas celulares que incluyen
reacciones alérgicas e inflamatorias, vasodilatación, secreción gástrica y
neurotransmisión. Puede existir en una variedad de formas a diversos pH, así
por ejemplo a pH de 7,4 se le encuentra en estado ionizado con un sitio
protonado en su cadena.
Como
consecuencia de un pequeño cambio de pH, de seis a siete, la histamina puede
cambiar de ser un aceptor de cargas, a ser un donador de cargas; por eso que,
no debe sorprendernos que debido a estas propiedades electrónicas, la histamina
presente una actividad fisiológica muy importante. El nivel de histamina en la
sangre normalmente se reporta entre los 25 y 130 µg/Lt, este rango puede
alterarse en caso de estimulación. Cuando el nivel de histamina circulante es
elevado, se generan desequilibrios que alteran el estado normal del individuo.
La liberación de histamina de las células es la primera respuesta frente a
algunos estímulos; entre estos se incluyen la presencia de toxinas bacterianas,
picaduras de insectos, destrucción celular por cambios de temperaturas
extremas, traumas, alergias, anafilaxis y reacciones de hipersensibilidad.
El
mecanismo de acción de la histamina sobre los tejidos describe su efecto sobre
la unión de dos tipos de receptores designados como H1 y H2 que están
localizados en la superficie de las células blanco, teniendo distintos tipos de
acción en diferentes tejidos de acuerdo al receptor al que estén unidos. Así,
cuando la histamina está actuando sobre el receptor H1 solamente, el músculo
liso bronquial e intestinal se contraen, las terminaciones nerviosas causan
dolor y picazón y se incrementa la producción de moco bronquial y nasal. Cuando
actúa solo sobre el receptor H2, en el estómago se estimula la secreción del
ácido clorhídrico. Cuando está unido a ambos receptores, el sistema
cardiovascular sufre vasodilatación periférica (baja presión arterial),
mientras aumenta la permeabilidad de los otros capilares con pérdida de fluidos
(edemas, zonas enrojecidas).
La
histamina exógena, es decir, histamina que no es sintetizada por el organismo,
sino que su presencia está ligada al consumo de alimentos usados como vehículos
para su ingreso al organismo, genera una enfermedad conocida comúnmente como
"intoxicación" con un período de incubación típicamente corto,
subsistiendo los síntomas por unas pocas horas en la mayoría de los casos. La
intoxicación por histamina presenta síntomas de naturaleza neurológico-cutánea,
gastrointestinal y hemodinámica, observándose luego del consumo del alimento:
edema, inflamación, dolor de cabeza, palpitaciones, enrojecimiento, hormigueo, urticaria,
quemazón, comezón, sarpullidos, nausea, vómito, diarrea, calambres e
hipotensión. La severidad de los síntomas de la intoxicación dependerá entonces
de la cantidad de histamina consumida, de la presencia de otros reaccionantes,
sinérgicos y antagónicos, así como de la sensibilidad del paciente a la
ingestión de éstos compuestos. El diagnóstico de la enfermedad debe ser
estudiado con mucho detenimiento, pues puede ser confundida con una
"alergia" por consumo de alimentos.
Así,
la intoxicación debe ser distinguida por presentar:
·
Carencia
de historias previas de reacciones alérgicas (antecedentes) por consumo de
algún alimento en particular
·
Presencia
de intoxicación en más de una persona
·
Detección
de altos niveles de histamina en el alimento consumido
Algunos
alimentos como pescados y mariscos, quesos (especialmente los de prolongada
maduración), jamones y otros de tipo fermentado, contienen algunas veces,
elevados niveles de histamina y han sido involucrados en apariciones de
intoxicación. Normalmente pequeñas cantidades de histamina presentes en la
dieta casi no tienen efectos dañinos, pues éstas son removidas por la flora
presente en el tracto digestivo impidiendo su absorción, sin embargo, en
algunos casos, la histamina presente en altas concentraciones, atraviesa la
barrera gastrointestinal, en cuyo caso puede ocurrir la intoxicación; la
intensidad de ésta, dependerá de las concentraciones circulantes de histamina.
Lamentablemente
no existe una buena relación estadística sobre la incidencia / prevalencia del
envenenamiento por histamina (escombrotoxina), debido principalmente a la falta
de programas de salud y a las características propias de la enfermedad que es
de curso muy corto; siendo la terapia antihistamínica el tratamiento óptimo
para este tipo de intoxicación. El conocimiento actual sobre los mecanismos de
la escombrotoxicosis no es a la fecha definitivo. Se considera necesaria la
revisión de los estudios científicos referentes, para establecer o modificar
los límites de acción legal en el nivel de histamina a fin de establecer normas
sanitarias. Mientras no se determine la identidad de las toxinas involucradas
en el envenenamiento, los niveles y la acción de los potenciadores, es
imposible definir una dosis tóxica para la histamina presente en los pescados.
Administrando hasta 4 mg de histamina pura / kg de peso corporal a voluntarios
controlados no se lograron tener efectos de toxicidad, mientras que con sólo
administrar filetes de caballa con histamina, a estos mismos voluntarios (0,3
mg de histamina / kg de peso corporal), se produjeron síntomas de
envenenamiento.
En
la mayoría de casos, los niveles de histamina encontrados en pescados asociados
a la enfermedad conocida como escombrotoxicosis, están por encima de los 200
ppm y más comúnmente, por encima de 500 ppm . Sin embargo, se sospecha que
otros productos químicos también juegan un rol importante en la aparición de la
enfermedad, como son otras aminas biogénicas, toxinas, inhibidores enzimáticos,
etc. que se generan por acción bacteriana y no se destruyen durante los
procesos de congelación, cocción, curado o conservería. Si bien se ha
encontrado una relación directa entre la intoxicación y el consumo de pescado
que contiene niveles elevados de histamina; aún no se ha determinado al agente
causal en sí de la escombrotoxicosis, pues no se ha logrado reproducir la
enfermedad al administrar histamina pura a voluntarios que si enfermaron al
consumir dosis semejantes en pescado.
La
falta de toxicidad de la histamina pura, dada en forma oral aún en niveles
elevados, y, la toxicidad generada por la ingestión de pequeñas dosis de
histamina en pescado, lleva a sospechar de la presencia de algunos
"potenciadores de toxicidad" en el pescado descompuesto. Entre los
posibles potenciadores están la trimetilamina, el óxido de trimetilamina y
otras aminas biogénicas tales como la putrescina, la cadaverina, anserina,
espermina, espermidina y agmantina. Los estudios hechos con dichos
"potenciadores" aún no han llegado a conclusiones determinantes. La
existencia de inhibidores de la diamino oxidasa y de la histamina metil
transferasa, también incrementarían la toxicidad, debido a que la remoción de
las aminas biogénicas a nivel del tracto digestivo se vería perjudicada,
ingresando las aminas en forma activa al torrente sanguíneo. Estudios con
voluntarios médicamente controlados, han demostrado que, las aminas encontradas
comúnmente en la caballa no son agentes responsables de la escombrotoxicosis,
no presentando acción individual, aditiva o sinergista ni otro tipo de
respuestas a dosis típicas. Estos mismos estudios sugieren que la liberación de
la histamina endógena (histamina liberada por los mastocitos), es la que juega
un rol importante en la intoxicación.
Por otro lado, hay evidencias que señalan
que algunos peces podrían acumular toxinas marinas provenientes de sus
alimentos (plancton, larvas de crustáceos, huevos de peces, juveniles, etc.), y
generar intoxicaciones de manera similar a la escombrotoxina, aunque aún faltan
mayores estudios al respecto. Todas éstas observaciones conducen a suponer que
la escombrotoxina es el agente degranulante de los mastocitos, y, que los
síntomas del envenenamiento son debido a la liberación de la histamina endógena
y otras sustancias biológicamente activas, liberadas por nuestro organismo.

Podemos
pensar que algunas moléculas de origen externo (histamina, otras aminas
biogénicas, inhibidores enzimáticos y toxinas), en conjunto, presenten una
acción aditiva y/o potenciadora de la intoxicación, todo dependería de la
concentración de cada una de ellas y de su efecto sobre las características
propias del hospedero; no debiendo involucrar solo a una molécula como la
responsable de la escombrotoxicosis. Si bien no se puede hablar directamente de
la histamina como único agente responsable de la escombrotoxicosis, de lo que
no hay duda es, de la relación directa entre la aparición de la intoxicación y
de la presencia de niveles elevados de histamina en los pescados consumidos. La
dosis tóxica mínima no ha sido aún establecida, debido a la variabilidad de los
niveles de histamina en el pescado descompuesto, así como a la variabilidad de
respuesta de los pacientes. La dosis tóxica a fines de la década de los 50 fue
establecida en 60 mg/100 g, aunque con el correr de los años este dato ha sido
cuestionado y corregido.
Estudios
epidemiológicos, han llegado a las siguientes conclusiones para la
concentración de histamina en los pescados:
- < 5 mg/100g de Hm (< 50 ppm): Pescado normal, seguro para su consumo.
- 5 - 20 mg/100g de Hm (50 - 200 ppm): Pescado maltratado y posiblemente tóxico.
- 20-100 mg/100g de Hm (200 - 1000 ppm): Pescado no satisfactorio probablemente tóxico.
Cabe
puntualizar que, si bien la norma europea solo contempla a los escómbridos y a
los clupeidos, actualmente, algunos países como Nueva Zelandia, está
considerando especies de riesgo a todas aquellas que contengan un alto
contenido de histidina libre en el músculo; así también, el Arenque del
Atlántico (clupeido), inicialmente considerado entre el grupo de especies
afectadas por la formación de histamina, ha sido retirada de la lista de Guía
de Peligros que maneja FDA de Estados Unidos. Reglamentaciones dadas por los
Estados Unidos, sobre niveles de histamina en pescados están contemplados en la
guía de la FDA (Food and Drugs Administration). La Guía de Control y Peligro de
Pescados y Productos Pesqueros de la FDA , establece que los
niveles de histamina no deberán exceder los 5 mg/100 g (50 ppm) para pescado
fresco y de los 20 mg/100 g (200 ppm) para pescado enlatado.
En
la calificación del producto debe tenerse en cuenta tanto los factores
intrínsecos (proteína, histamina, bases volátiles, etc.) como su aporte en la
masa total del alimento a consumirse. Así por ejemplo, la harina de pescado,
que es usada como ingrediente en la preparación de alimentos balanceados y ésta
solo aporta alrededor de un 10% del total del producto, entonces, una harina de
250 ppm en un alimento balanceado aportará solo un décimo (1/10) de su masa, el
valor final de histamina en el alimento será de 25 ppm (valor no peligroso).
Algunas especies de pescados contienen naturalmente grandes cantidades de
histidina libre en sus tejidos; además que la proteólisis, ya sea autolítica o
bacteriana, puede jugar a su vez un rol importante en la liberación de más
histidina que puede servir como sustrato a la histidina descarboxilasa
bacteriana. La formación de histamina es resultado del mal manipuleo y una mala
preservación del pescado; generalmente pescados almacenados en lugares con poca
higiene y a temperaturas por encima de las de refrigeración en tiempos
prolongados, son susceptibles a formar grandes cantidades de histamina, siempre
que presenten histidina libre en sus músculos.
Algunas
malas prácticas de captura, generalmente cuando al pescado se le ha permitido
luchar sobre la línea por un período relativamente prolongado de tiempo, pueden
causar un incremento de la temperatura interna, favoreciendo el crecimiento
bacteriano, formándose histamina antes de que el pescado esté sobre la
embarcación. Existen medios microbiológicos enriquecidos con extractos de
músculo de pescado que permiten aislar y cuantificar las bacterias formadoras
de histamina. Diversas referencias indican que sólo un porcentaje menor de
microflora contaminante, es responsable de la formación de histamina, lo cual
nos llevaría a concluir que, no siempre los niveles de histamina indican el mal
estado del producto, pues el pescado también puede ser contaminado con
bacterias que no producen histamina, formando otros productos de
descomposición. Se han reportado ocurrencias de formación de histamina aún a
temperaturas moderadas (entre los 4 y los 10°C) siendo todavía tema de
controversia. Las bacterias formadoras de histamina son capaces de crecer y
producirla en un amplio rango de temperaturas, sin embargo, su acción es más
rápida a temperaturas que fluctúan alrededor de 21ºC o más.
Las
bacterias asociadas a la formación de histamina están comúnmente sobre las agallas
y en los intestinos del pez vivo sin originar daño; una vez muerto el pez, sus
mecanismos de defensa no inhiben el crecimiento bacteriano, aumentando el
número de bacterias que aprovechan la histidina libre presente en al medio.
Enterobacterias (especialmente especies de Proteus y Klebsiella) forman
histamina como producto secundario de su metabolismo por acción de su enzima
histidina descarboxilasa. Al investigar la microflora responsable de la
descomposición, es importante identificar a las bacterias formadoras de
histamina, a fin de determinar el porcentaje de la población bacteriana total
que ellas representan. Las bacterias intestinales formadoras de histamina más
abundantes en el pescado son: Morganella morganii, Klebsiella pneumoniae,
Proteus vulgaris y Hafnia alvei, éstos han sido aislados de pescados implicados
en la mayoría de envenenamientos.
Ciertas
bacterias no intestinales del pescado son también capaces de producir histamina
en condiciones de anaerobiosis (Clostridium perfringens); a temperaturas de
refrigeración (la psicrófila Photobacterium spp); a temperaturas de
refrigeración y salinidad elevada, perteneciendo a este último un grupo de
bacterias psicrofílicas y halofílicas denominadas "bacterias
grupo-N". La mayor parte de estudios toman como consenso que las bacterias
formadoras de histamina son principalmente organismos mesófilos (adaptados a
temperaturas entre los 20 y 37°C), sin embargo, se ha demostrado que Klebsiella
pneumoniae es capaz de producir histamina a 7ºC después de prolongados períodos
de almacenamiento; y las aún no identificadas "bacterias grupo-N",
que parecen formar parte de la microflora normal de la superficie del pescado,
son capaces de producir histamina a temperaturas de hasta 2,5ºC. Se ha observado
también la aparición de histamina en filetes empacados al vacío y almacenados a
temperaturas de refrigeración, así como en productos salados almacenados a 5ºC;
el principal argumento para esta formación es que, una vez presente la enzima
histidina descarboxilasa, ésta puede continuar la producción de histamina en el
pescado, aún cuando la bacteria deje de ser activa (muerta o con metabolismo
mínimo).
La
enzima puede continuar activa a temperaturas de refrigeración y es
probablemente más estable en estado congelado que dentro de la célula
bacteriana misma (mínima acción de proteasas), pudiendo reactivarse muy
rápidamente durante el descongelamiento. Tanto la enzimas como las bacterias
pueden ser inactivadas por cocción; sin embargo una vez que la histamina ya
está formada no es posible eliminarla. Después de la cocción del pescado, la
recontaminación con bacterias formadoras de histamina es poco probable (por la
menor proporción de ellas en el ambiente), por esta razón el desarrollo de
histamina es más frecuente en pescados crudos. Considerando que el efecto de la
temperatura en la formación de histamina es determinante, el rápido
enfriamiento del pescado después de muerto es la principal estrategia para
prevenir la formación de histamina (escombrotoxina). El almacenamiento a bajas
temperaturas después de la captura, es la clave para el control en la
acumulación de la histamina bacteriana en el pescado, aunque, es necesario aún
investigar más a fondo la formación de histamina en el almacenaje a bajas
temperaturas.
La
temperatura interna del pescado deberá ser llevada a 10ºC o menos durante las
primeras 6 horas después de capturado el pez. Luego de éste enfriamiento
inicial, es recomendable llevar a los pescados por debajo de los 4°C dentro de
las 18 horas siguientes; éstas acciones previenen, el crecimiento bacteriano y
acción de la histidina descarboxilasa. Una vez que la enzima esté formada el
control del peligro es improbable. Se debe tener en cuenta también las
variaciones estacionales de los aminoácidos libres en el músculo del pescado.
Existe información que nos indica que la concentración de histamina libre en el
músculo varía según las estaciones, llegando a concluir que existen épocas
donde hay más susceptibilidad para formar mayor concentración de histamina.
Estudios relacionados a la preservación del pescado, encontraron que, tanto el
uso del ácido propiónico como del ácido acético, en cantidades adecuadas,
retardan el crecimiento bacteriano; por tanto, el uso de éstos preservantes,
puede conducir a una menor formación de histamina, otras aminas biógenas u
otros productos provenientes del deterioro. Actualmente se están estudiando
otros inhibidores del crecimiento bacteriano de origen natural (bactericidas
y/o bacteriostáticos) con la finalidad de disminuir la formación de productos
de descomposición.
FITOHEMAGLUTININA
También
se conoce como envenenamiento por habichuelas rojas, envenenamiento por judías
Kintoki, y posiblemente por otros nombres, y es causada por una lectina o hemaglutinina.
Las lectinas son sustancias químicas muy comunes en las plantas, y algunas de
ellas hacen que la sangre se aglutine, por lo que reciben el nombre de
hemaglutininas. Las fitohemaglutininas, el supuesto agente tóxico, se encuentra
en muchas especies de judías, pero donde se encuentran en mayor concentración
es en los frijoles rojos (Phaseolus vulgaris). La unidad de medida de las
toxinas es la unidad de hemaglutinación (hau). Los frijoles rojos crudos
contienen de 20.000 a 70.000 hau, mientras que cuando están completamente
cocinados contienen de 200 a 400 hau. Las judías blancas, otra variedad de
Phaseolus vulgaris, contienen acerca de un tercio de la cantidad de toxina
contenida en la variedad roja; Las habas (Vicia faba) contienen de un 5 a un
10% de la cantidad contenida de las habichuelas rojas. Los casos (de los que se
da noticia) son muy raros y están de manera mayoritaria limitados al Reino
Unido.
El
tiempo que transcurre desde que se consumen las judías crudas o poco cocinadas
hasta que aparecen los síntomas varía de 1 a 3 horas. El comienzo está marcado
normalmente por nauseas extremas, seguidas de vómitos, que pueden ser severas.
La diarrea se desarrolla algo más tarde (de una a unas pocas horas), y algunas
personas sufren dolor abdominal. Algunas personas han sido hospitalizadas, pero
normalmente la recuperación es rápida (3 4 hs después del comienzo de
los síntomas) y espontánea. El curso de la enfermedad es rápido. Todos los
síntomas normalmente se resuelven varias horas después del comienzo. El vómito
normalmente se describe como abundante, y la severidad de los síntomas se
relaciona directamente con la dosis de toxina (número de judías crudas
ingeridas). La hospitalización se ha dado ocasionalmente, y puede que se tengan
que administrar fluidos intravenosos. Aunque son de poca duración, los síntomas
son extremadamente debilitantes. La diagnosis se hace en base a los síntomas,
la historia alimentaria y la exclusión de otros agentes alimentarios venenosos
de acción rápida (por ejemplo, Bacillus cereus, Staphylococcus aureus,
arsénico, mercurio, plomo, y cianuro). El síndrome es probablemente esporádico,
afectando a pequeños números de personas o individuos, y se diagnostica
erróneamente de manera fácil o nunca se da noticia de ello debido a la corta
duración de los síntomas. El síndrome normalmente es causado por la ingestión
de judías crudas que han estado en remojo, ya sean solas o en ensaladas o
guisos. La cantidad de cuatro o cinco judías ya pueden causar los síntomas.
Se
han asociado varios brotes con los robots de cocina “crock pots”, o con guisos
en los que la temperatura alcanzada no ha sido la suficiente para destruir la
glicoproteína lectina. Se ha demostrado que al calentar hasta 80ºC se puede
multiplicar la toxicidad por cinco, así que estas judías son más tóxicas si se
comen crudas. En estudios de guisos cocinados en robots de cocina, la
temperatura interna, normalmente no ha excedido los 75ºC. El cocinado adecuado
destruye las lectinas, pero el cocinado no adecuado, como se ha mencionado
arriba, puede incrementar la toxicidad inicial. Todas las personas, sin influir
la edad o el género, parecen ser igualmente susceptibles; La severidad se
relaciona solamente con la dosis ingerida. Las lectinas son glicoproteínas,
presentes tanto en animales como en vegetales bacterias o virus, que se
caracterizan por ser capaces de unirse a carbohidratos específicos, libres o
que forman parte deglicanos de de glicoproteinas.
Si
estos carbohidratos se encuentran en las membranas de loe eritrocitos, las
lectinas que los reconocen provocan su aglutinación, por lo que reciben el
nombre de hemaglutininas, fitohemaglutininas en el caso de ser lectinas
vegetales. La primera lectina, extremadamente tóxica, fue descubierta por Stillmark
en 1888, en las semillas del ricino, y se les dio el nombre de “lectinas” en la
década de 1950, pero por el momento no se sabe exactamente cuál puede ser su
función biológica. Es posible que sea muy diversa, desde el reconocimiento del
propio polen a la defensa frente a insectos. Independientemente de esto, las
lectinas son heramientas muy utilizadas en bioquímica, para el estudio de
glicoproteínas, así como en biología celular y en investigación médica. Aunque
existen lectinas en todos los cereales y leguminosas, desde el punto de vista
de la Ciencia y la Tecnología de los Alimentos, las fitohemaglutininas más
importantes son las presentes en las alubias y habas, ya que pueden dar lugar a
intoxicaciones si no se cocinan adecuadamente.
Existen
al menos cuatro, muy parecidas, designadas con las letras E (que aglutina
eritrocitos), L (aglutina leucocitos), P y M. No se conoce exactamente la
estructura que reconocen las lectinas de alubia pero son oligosacáridos
complejos que incluyen restos de N-acetil-alfa -D-galactosamina unidos a otros
monosacáridos, probablemente de diferente forma para cada lectina. Su unión no
se ve inhibida por la presencia de ningún monosacárido, como sucede con otras
lectinas. El peso molecular de estas lectinas es de alrededor de 128.000, y
están formadas por la unión, no covalente, de cuatro subunidades distintas.
Cada subunidad lleva unidos, muy próximos, un átomo de calcio y otro de
manganeso, que son indispensables para el mantenimiento de su actividad. Cuando
se ingieren leguminosas con fitohemaglutininas, éstas, se unen a las membranas
de las células del tubo digestivo, produciendo rápidamente nauseas y vómitos, y
a veces posteriormente diarrea y molestias abdominales. La enfermedad remite
espontáneamente en pocas horas.
Las
fitohemaglutininas son especialmente abundantes en las judías rojas (Phaseolus
vulgaris), hasta el extremo de que bastan media docena de judías mal cocinadas
para producir efectos nocivos. Las alubias blancas contienen solamente alrededor
de un tercio de la cantidad de toxina que tienen las rojas, y las habas menos
del 10%. Las fitohemaglutininas se desnaturalizan por calentamiento, por lo que
desaparecen (en un 99%) si las legumbres se han cocinado correctamente, Ahora
bien, un tratamiento térmico inadecuado (a una temperatura del orden de los 80º
C) multiplica su acción tóxica. La intoxicación por alubias rojas es
relativamente frecuente en Gran Bretaña, donde, al utilizarse en ensaladas, se
cocinan con menos intensidad. En el maní (Arachis hypogaea) existe una lectina,
también tetramérica, como la de la alubia roja, que es capaz de reconocer
unidades de beta-D-galactosa. También son abundantes en lentejas, guisantes,
soja y trigo germinado. Las lectinas de soja tienen afinidad por oligosacáridos
que incluyen galactosa, las de lenteja, guisante y haba tienen afinidad por
grupos de manosa, y las de patata y trigo germinado, por grupos de n-acetil
quitobiosa. En ninguno de estos casos se conocen intoxicaciones debidas a
ellas.
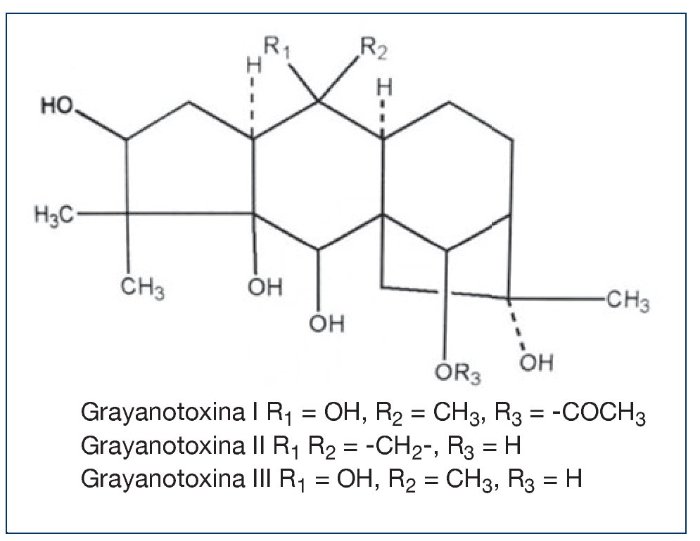
GRAYANOTOXINA

La
grayanatoxina (antes conocida como andromedotoxina, acetylandromedol, y
rhodotoxina) causa la “Intoxicación por Miel”. La intoxicación por miel es
causada por el consumo de miel producida con el néctar de los rododendros. Las
grayanotoxinas causan la intoxicación. Puede que las grayanotoxinas específicas
varíen con la especia de planta. Estos compuestos son diterpenos, hidrocarburos
cíclicos polihidroxilados que no contienen nitrógeno. Otros nombres asociado
con la enfermedad con envenenamiento por rododendro, intoxicación de la miel
loca o envenenamiento por grayanotoxina. El envenenamiento por grayanotoxina en
humanos no es frecuente. Sin embargo, se deberían anticipar los casos de
intoxicación con miel, en todas partes.
Esta
intoxicación raramente es fatal y generalmente no dura más de 24 horas.
Generalmente la enfermedad induce vértigos, debilidad, transpiración excesiva,
nausea, y vómitos poco tiempo después de la ingestión de la miel tóxica. Otros
síntomas que pueden ocurrir son baja presión sanguínea o shock, bradiarritmias,
ritmo bajo en el seno, con un ritmo cardíaco de menos de 60), ritmo nodular
(perteneciendo a un nódulo, particularmente el nódulo atrioventricular),
síndrome de Wolff Parkinson White (excitación anómala atrioventricular) y
bloqueo completo atrioventricular. Las grayanotoxinas se unen a los canales de
sodio en las membranas celulares. Estos compuestos previenen la inactivación;
por lo tanto, las células excitables (nervio y músculo) se mantienen en un
estado de despolarización, durante el cual se puede facilitar la entrada de
calcio en las células.
Esta
acción es similar a la ejercida por los alcaloides de veratrum y aconitum.
Todas las respuestas observadas de los músculos cardíacos y óseos, los nervios,
y el sistema nervioso central están en relación con los efectos de la membrana.
Como la intoxicación es pocas veces fatal y la recuperación generalmente se da
dentro de 24 horas, puede que no se necesite intervención. El envenenamiento
por grayanotoxina resulta frecuentemente de la ingestión de miel contaminada
con grayanotoxina, aunque puede resultar de la ingestión de hojas, flores y
néctar de rododendro. No todos los rododendros producen grayanotoxinas. El
Rhododendron ponticum crece de manera extensiva en las montañas del este del
Mar Negro, de Turquía. Estas especies se han asociado con el envenenamiento
mediante miel desde el 401 A .C. Otras especies de rododendros y otros miembros
de la familia botánica de las Ericaceae , a la que pertenecen los rododendros,
pueden producir toxinas, pero generalmente no están implicadas con esta
enfermedad. El laurel de montaña (Kalmia latifolia ) y el laurel de oveja
(Kalmia angustifolia ) probablemente sean las fuentes más importantes de la
toxina. El deseo incrementado del público por los alimentos naturales (sin
procesar), puede resultar en más casos de envenenamiento por grayanotoxina. Los
individuos que obtengan miel de los granjeros que pude que solo tengan unas
pocas urticarias, están sometidos a un riesgo mayor, especialmente cuado la
miel ha sido recolectada de las plantas mencionadas anteriormente. La unión de
cantidades masivas de miel durante el procesado comercial generalmente diluye
cualquier sustancia tóxica.

Todas
las personas que creen que pueden ser susceptibles a una intoxicación por miel.
Con todo, las toxinas no son concentradas como en las plantas que crecen en
regiones húmedas a nivel del mar o bien en zonas montañosas áridas. Las
especies de Rododendron cultivadas en parques y jardines tienen una cantidad
mínima de toxina, es imprudente comer las hojas coriáceas, pero ninguna
intoxicación con miel proveniente de estos híbridos se ha asociado debido a sus
suaves toxinas. La radiación gamma constituye una de las técnicas profilácticas
no destructivas para el control de enfermedades avícolas. Aunque ya se contaba
con estándares internacionales para niveles permitidos de pesticidas en
alimentos como leche, frutas y verduras, la miel había quedado en un segundo
plano. Los controles de plaguicidas en miel no ha sido realizados regularmente,
por no haber detectado el riesgo de contaminación. Gas y cromatografía líquida
se unen para facilitar la seguridad del polen, las abejas y la cera, técnicas
utilizadas por su especificidad, selectividad y sensibilidad y por la
posibilidad de detectar pequeñas concentraciones de fármacos en la muestra que
se analiza. Si bien el control sanitario de las enfermedades avícolas suele
realizarse a través de sustancias químicas como antibióticos, con el
consiguiente riesgo para contaminar las colmenas, la radiación gamma es una
técnica profiláctica no destructiva apta para el control de enfermedades.

TETRODOTOXINAS
Ciertas especies tropicales de peces globo desarrollan en
su hígado o intestinos una toxina, llamada tetrodotoxina, que puede producir
intoxicaciones a las personas que los consumen. Los síntomas más
característicos, que suelen ocurrir al cabo de dos o tres horas después de la
ingestión, son el adormecimiento de la lengua y de la boca, mareo, dolor en la
cabeza o caminar vacilante. En fases más avanzadas se va produciendo una
parálisis general con posibilidad, si no se actúa rápidamente, de parada
cardiorrespiratoria y muerte al cabo de 4 o 6 horas. Es una intoxicación extremadamente
grave que produce la muerte en la mitad de las personas afectadas. La tetrodotoxina es un compuesto tóxico
producido por el pez globo. El envenenamiento por consumo de miembros del orden
Tetraodontiformes es una de las intoxicaciones más violentas de especies
marinas. Las gónadas, el hígado, los intestinos y la piel del pez globo pueden
contener el nivel suficiente de tetrodotoxina como para causar una muerte
rápida y violenta. La carne de muchos peces globo no suele ser tóxica hasta un
nivel peligroso.
La
tetrodotoxina también se ha aislado de especies animales muy diferentes,
incluidas el tritón de California, el pez loro, las ranas de género Atelopus,
los pulpos de anillos azules, las estrellas, los peces ángel y el cangrejo
xántido. La fuente real de la tetrodotoxina es incierta. No se ha identificado
su origen en ningún alga, y hasta hace poco se asumía que la tetrodotoxina era
un producto metabólico del huésped. Sin embargo, trabajos recientes sobre la
producción de tetrodotoxina /anhidrotetrodotoxina por varias especies
bacterianas, incluyendo cepas de las familias Vibrionaceae, Pseudomonas s p., y
Photobacterium phosphoreum, apuntan a que esta familia de toxinas tiene origen
bacteriano. Estas bacterias marinas relativamente comunes, normalmente están
asociadas a animales marinos. Si se confirmaran, estos descubrimientos tendrían
algún significado en toxicosis que se han relacionado más directamente con
estas especies bacterianas.

El
primer síntoma de la intoxicación es un ligero adormecimiento de los labios y
la lengua, que aparecen entre 20 minutos y 3 horas después de haber comido pez
globo venenoso. El siguiente síntoma es una parestesia creciente en la cara y
en las extremidades, a la que pueden seguir sensaciones de ligereza, o de
estar flotando. Puede haber migrañas, dolor epigástrico, nauseas, diarrea y
vómitos. Ocasionalmente, puede darse cierto tambaleo o dificultad al caminar.
La segunda etapa de la intoxicación es una parálisis creciente. Muchas víctimas
no son capaces de moverse; incluso el estar sentado puede resultar difícil. Se
da dolor respiratorio creciente. El habla se ve afectada, y la víctima
habitualmente exhibe cianosis, e hipotensión. La parálisis aumenta y puede que
se den convulsiones, discapacidad mental, y arritmias cardíacas. La
víctima, aunque está completamente paralizada, puede ser consciente y en
algunos casos estar completamente lúcido hasta poco antes morir. La muerte se
da normalmente entre 4 y 6 horas, con un rango de entre 20 minutos y 8 horas.
El diagnóstico del
envenenamiento por consumo de pez globo se basa en observar la sintomatología y
la historia alimentaria reciente. Los envenenamientos de tetrodotoxina se han
asociado casi exclusivamente con el consumo de peces globo de aguas de las regiones
del océano Indo Pacífico. Se han informado de varios casos de envenenamiento,
casos fatales incluidos, relacionados con peces globo del océano Atlántico, el
golfo de México y el golfo de California. No se ha confirmado ningún caso de
envenenamiento con peces globo del Atlántico, Spheroides maculatus. Las
caracolas Charonia sauliae han estado implicadas en envenenamientos
alimentarios, y hay evidencias que sugieren que contienen un derivado de la
tetrodotoxina. Se estima un total de unos 200 casos al año de los que se ha
informado de una mortalidad que se acerca al 50%, prácticamente todos en Japón,
ya que los casos en países fuera del área Indo Pacífica son muy escasos.
Esta
toxicosis se puede evitar no consumiendo paz globo u otras especies animales
que no contengan tetrodotoxina. Se sabe que muchas otras especies animales
contienen tetrodotoxina y normalmente no son consumidas por humanos. Todos los
humanos son susceptibles de envenenarse con tetrodotoxina. El envenenamiento
con tetrodotoxina es una preocupación sanitaria de primer orden en Japón, donde
el “fugu” es una delicia tradicional. Se prepara y vende en restaurantes
especiales donde individuos entrenados y con licencia quitan las vísceras con
cuidado para reducir el riesgo de envenenamiento. La importación de pez globo a
países europeos o a Estados Unidos no está permitida por lo general, aunque
puede que se den excepciones especiales. En productos de pescado congelado o
preparado, puede darse tanto un mal etiquetado como una identificación
incorrecta.
"SOMOS LO QUE HACEMOS REPETIDAMENTE. EXCELENCIA, POR LO TANTO, NO ES UN ACTO SINO UN HÁBITO"
ARISTOTELES
LEGALES: El autor no asume responsabilidad alguna por la descarga, copia, distribución, modificación o alteración de los contenidos publicados, sean propios del mismo o de terceros, los cuales pudieren estar protegidos por Copyright, Derechos de Propiedad Intelectual, Derechos de Autor, o relacionados. La Bibliografía del tema expuesto y el crédito fotográfico está en poder del Autor y no se publica dada su extensión, pero se enviará por mail al interesado que la solicitare debidamente fundamentada


Todas las bases de ADN, incluida la adenina, que también se muestran aquí, tienen carácter aromático. https://bibliotheque-du-capucin.com/como-identificar-un-compuesto-aromatico/
ResponderBorrar