LAS ENTEROBACTERIAS (Parte 7)
Género Morganella
Morganella, pertenece a la familia
Enterobacteriaceae y hasta el momento, presenta una sola especie: morganii.
Inicialmente, Morganella morganii recibió el nombre de Proteus morganii, pero
por estudios genéticos, se le sacó del género Proteus y se creo el género
Morganella.
Este último género, presenta un INVIC: + +
- - , es capaz de hidrolizar la urea, tiene una movilidad variable
a 37° C y produce ácido y gas a partir de la glucosa. Además, es capaz de reducir los nitratos a nitritos,
de fermentar la manosa y como todos los integrantes de la familia
Enterobacteriaceae, es oxidasa negativo.
Las cepas de Morganella morganii, crecen
bien en los medios de aislamiento primarios como el agar sangre y el agar
McConkey, no son hemolíticas y usualmente no producen el fenómeno de
"swarming" como Proteus. En épocas recientes, se propuso la creación
de una sub clasificación de este género en dos sub especies: Morganella
morganii ssp. morganii y Morganella morganii ssp. sibonii.
M. morganii, es causa conocida de infecciones
del tracto urinario y fuera del tracto urinario, puede producir diversos tipos
de infecciones. Por otra parte, se le ha relacionado como un patógeno entérico,
sin embargo aquí, su papel etiológico es dudoso. En forma reciente, se documentó un caso de
una corioamnionitis y sepsis asociada, caso complicado con un síndrome de
distress respiratorio, además de infecciones en el recién nacido.
Este agente, rara vez es causa de
infecciones invasivas en personas inmunocompetentes, pero sí puede ser una
causa probable de infecciones nosocomiales en personas irimunocomprometidas.
Esta bacteria, presenta una resistencia intrínseca a la polimixina, ampicilina
y a cefalotina y se ha documentado que es capaz de producir una beta lactamasa
inducible o la beta lactainasa de efecto expandido.
Todo esto, claro está, cuando el agente se
ve expuesto a un agente inductor y las enzimas producidas, hidrolizan a las
penicilinas y cefalosporinas de efecto expandido. Generalmente, estas bacterias
dejan de producir la enzima cuando el agente inductor es removido, aún cuando,
algunas cepas mutan a un estado de continua producción de beta lactamasa. Todo esto nos habla de un agente con una
alta resistencia antimicrobiana, tanto natural (intrínseca) como adquirida.
Género Providencia
Providencia rettgeri (antes Proteus rettgeri) es una bacteria móvil perteneciente al género Providencia, que junto a Proteus y Morganella forman la tribu Proteeae o Pro. Componente normal de la flora colónica en el hombre, se diferencia de otras especies de Providencia en que hidroliza rápida y abundantemente la urea pero no metaboliza a la lactosa como los otros integrantes de Enterobacterias.
Como patógeno humano se ha descripto como causante de infecciones urinarias, sobre todo en pacientes mayores y con catéteres uretrales, y en infecciones de heridas en pacientes inmunodeprimidos y quemados. A diferencia de P. stuartii son muy escasas las publicaciones de bacteremias causadas por este microorganismo.
En una revisión
bibliográfica en PubMed utilizando los términos ''Bacteriemia y Providencia
rettgeri'' aparecen sólo 2 casos de sepsis fatal en probable relación a
contaminación de hemoderivados y algún caso aislado en grandes series de
bacteriemias.
Por otra parte,
Providencia alcalifaciens es un miembro bastante semejante al anterior y
perteneciente también a la familia Enterobacteriaceae.


Hay informes que P. alcalifaciens puede causar diarrea, pero el mecanismo por el que la causa no es bien conocido. El modelo de condensación de la actina era diferente del producido por la toxina enteropatogénica de Escherichia coli pero similar a Shigella flexneri. Se concluye que algunas algunas subespecies de P. alcalifaciens son los enteropatogénicos y que ellos causarían los cuadros de diarrea invadiendo el epitelio de la mucosa intestinal.
Género Yersinia
Este género comprende
varias especies entre ellas Yersinia pestis, agente de la
Peste Negra o Plaga Bubónica o Neumónica, comúnmente llamada la
Muerte Negra, enfermedad de los roedores, trasmitida ocasionalmente al
hombre por las pulgas, con pandemias históricas desde el siglo VI, donde mató a
un tercio de la población en Europa. Luego de la Edad Media ha habido
brotes en diversas partes del mundo, sobre todo en relación con las guerras.
Se han denunciado en
1995 y comienzos de 1996 casos en India, Madagascar y otros países africanos,
en Brasil y Perú. Y. pestis es endémica en algunas regiones tales como Irán y
el oeste de Estados Unidos. Otra especie, Y.
enterocolitica es muy ubiquitaria, se ingiere con agua o alimentos
contaminados. Algunos biotipos están relacionados con enterocolitis en el
hombre. Raramente presenta infecciones sistémicas. Sin embargo, las bacterias
atraviesan con frecuencia la mucosa y se multiplican en los nódulos linfáticos
mesentéricos. Debido a los intensos dolores abdominales el cuadro puede
confundirse con apendicitis. Ocasionalmente puede haber una artritis
reactiva 2 a 6 semanas luego de la infección. Esto se ve
frecuentemente en pacientes con antígeno HLA-B27 de histocompatibilidad. Cepas
virulentas de las 2 especies poseen al menos un gran plásmido de virulencia.
Y.
enterocolitica es una bacteria pequeña de forma redonda y Gram-negativa,
la cual es aislada frecuentemente de los especímenes clínicos tales como las
heridas, las heces fecales, el esputo o las glándulas linfáticas mesentéricas.
Sin embargo, no forma parte normal de la flora humana. Por otro lado, Y.
pseudotuberculosis ha sido aislada del apéndice infectado en los humanos.
Ambos organismos han
sido aislados frecuentemente de los animales, tales como los cerdos, las aves,
los castores, los gatos y los perros. Solamente la bacteria Y. enterocolitica
se ha encontrado en muestras ambientales de lagunas y lagos, y en alimentos
como la carne, los helados y la leche. La mayoría de los organismos aislados no
han sido catalogados como patógenos. El nombre de la
enfermedad causada por este microorganismo es yersiniosis.


Existen tres especies patogénicas dentro del género Yersinia, pero sólo Y. enterocolitica y Y. pseudotuberculosis causan gastroenteritis. Hasta el momento, se han reportado muy pocos casos de brotes causados por Y. pseudotuberculosis, como por ejemplo las presentadas en Japón, donde se reportaron infecciones en humanos transmitidas por alimentos y por aguas contaminadas.
La yersiniosis se
caracteriza generalmente por síntomas tales como la gastroenteritis con diarrea
y/o con vómito; sin embargo, la fiebre y el dolor abdominal son los síntomas
que la definen. Las infecciones causadas por Yersinia son similares a la apendicitis
y a la linfadenitis mesentérica, pero esta bacteria también puede causar
infecciones en otras áreas como en las heridas, en las articulaciones y en el
tracto urinario.

La dosis infecciosa es desconocida. La aparición de la enfermedad se da entre las 24 y 48 horas después de la ingestión, la cual es la ruta usual de infección (los alimentos y las bebidas son los vehiculos de transmisión). El diagnóstico de la yersiniosis se inicia con el aislamiento del microorganismo a partir de las heces fecales, de la sangre, o del vómito de la víctima, y a veces la muestra es tomada durante la apendicectomía. La confirmación se realiza con el aislamiento y la posterior identificación bioquímica y serológica de Y. enterocolitica, provenientes tanto del hospedero humano como del alimento ingerido. Se ha reportado que la diarrea ocurre en el 80% de los casos; y que los síntomas más confiables son el dolor abdominal y la fiebre.
Dada la dificultad para el aislamiento de yersiniae de las heces fecales, muchos países dependen de la serología. Para ello, a los pacientes críticos y convalecientes se les realiza un análisis en busca del serotipo de Yersinia spp. sospechoso.
Las cepas de Y.
enterocolitica se pueden encontrar en las carnes (de cerdo, la de carne de
vaca, la de cordero, etc.), en las ostras, el pescado, y la leche cruda. La
causa exacta de la contaminación de los alimentos es desconocida. Sin embargo,
la prevalencia de este organismo en el suelo y el agua, así como también en
ciertos animales como los castores, los cerdos, los conejos y las ardillas, ofrece grandes
oportunidades para que este organismo ingrese a la cadena alimentaria. La falta
de higiene de los manipuladores de alimentos y las técnicas de esterilización
inadecuadas, además del almacenamiento inapropiado, son también importantes
fuentes que contribuyen a la contaminación.

La Yersinia es sensible al calor y como resultado morirá durante el calentamiento (mayor a 70°C). L as principales causas de infección son el consumo de los alimentos crudos o parcialmente cocidos y así como la contaminación cruzada, que ocurre cuando los productos cocidos entran en contacto con los materiales crudos o contaminados (tablas para cortar). Por esta razón, la cocción adecuada y la higiene en el manejo de los alimentos pueden prevenir las infecciones causadas por Yersinia en una gran medida.
La Yersinia es sensible al calor y como resultado morirá durante el calentamiento (mayor a 70°C). L as principales causas de infección son el consumo de los alimentos crudos o parcialmente cocidos y así como la contaminación cruzada, que ocurre cuando los productos cocidos entran en contacto con los materiales crudos o contaminados (tablas para cortar). Por esta razón, la cocción adecuada y la higiene en el manejo de los alimentos pueden prevenir las infecciones causadas por Yersinia en una gran medida.
Las poblaciones más
susceptibles a la enfermedad principal y a sus posibles complicaciones son las
más jóvenes, también los débiles, los ancianos y las personas que se encuentren
bajo terapias inmunodepresivas.
El nombre del género
Yersinia viene dado por su descubridor, en 1894, Alexandre Yersin, bacteriólogo
franco-suizo del Instituto Pasteur. Originalmente, este microorganismo fue
denominado Pasteurella pestis, pero en el año 1967 fue renombrado como Yersinia
pestis en honor a su descubridor.

Yersinia pestis es un agente infeccioso que ha sido directamente responsable de más muertes humanas que cualquier otra enfermedad infecciosa, salvo la malaria. Ha originado diversas pandemias a lo largo de la historia, entre las que cabe destacar: la Plaga de Justiniano (541-542 dC), que asoló Asia, el norte de África, Arabia y parte de Europa; la Peste Negra (1347-1351 dC), que acabó con la vida de un tercio de la población de Europa; y la Tercera Pandemia (1855-1959), que comenzó en China e India y terminó por extenderse por el resto de Asia, África y América.
El papel de Y. pestis
en la Peste Negra se ha debatido entre los historiadores; algunos han
sugerido que la Peste Negra se propagó muy rápido para haber sido
causada por Y. pestis. Se ha encontrado ADN de Y. pestis en los dientes de
aquellos que murieron de Peste Negra pero, sin embargo, cadáveres medievales
que murieron de otras causas no dieron positivo a Y. pestis. Esto sugiere que
Y. pestis fue un factor que contribuyó a las plagas europeas, pero
probablemente no el único. Es posible que las presiones selectivas inducidas
por la plaga puedan haber cambiado el modo en que el patógeno se manifiesta en
humanos, seleccionándose en contra de individuos o poblaciones que eran más
susceptibles.
- Yersinia
pestis, agente de la denominada peste bubónica o peste negra, que asoló
Europa a mediados del siglo XIV. Esta especie presenta tres subespecies:
Y. pestis antiqua, Y pestis medievalis y Y. pestis orientalis.
- Yersinia
pseudotuberculosis, agente de una enfermedad parecida a la tuberculosis
que afecta a los nódulos linfáticos en animales y raramente en humanos.
- Yersinia
enterocolitica, agente de ciertas infecciones intestinales (a veces
también sistémicas) en humanos y animales.

El género Yersinia pertenece a las bacterias Gram-negativas aeróbicas facultativas con metabolismo fermentativo. Es un cocobacilo de tinción bipolar similar a otras Enterobacterias. Durante el proceso infeccioso genera viscosidad antifagocítica. El organismo presenta motilidad cuando es aislado, pero pierde esta capacidad mientras permanece en el mamífero húesped. La peste es una enfermedad natural de los roedores, siendo las ratas el principal reservorio de la enfermedad. Tras ser infectadas, la mayoría de las ratas mueren, pero un pequeño porcentaje consigue sobrevivir, quedando como una fuente de Y. pestis.

Las ratas son infectadas a través de un vector, que en este caso es la pulga de rata (Xenopssylla cheopis). La pulga chupa la sangre de un animal infectado e ingiere a la vez células de Y. pestis, las cuales se multiplican en el intestino de la pulga y serán transmitidas a otra rata en la siguiente picadura de la pulga. La enfermedad se irá extendiendo de forma que la mortalidad entre las ratas se hace tan elevada que la pulga busca nuevos hospedadores, entre los que se encuentra el hombre.
A continuación se exponen los tres tipos de infecciones a las que puede dar lugar Yersinia pestis:
Peste bubónica: En
el tipo de infección más común. Una vez que las células bacterianas han sido
introducidas mediante la picadura de una pulga dentro de un ser humano, las
células bacterianas se desplazan por el torrente sanguíneo hasta los nódulos
linfáticos donde generan pequeñas hinchazones denominadas bubones, que están
llenos de partículas bacterianas. La cápsula viscosa que rodea a las células de
Y. pestis evita que estas sean fagocitadas por los macrófagos.


En poco tiempo, los nódulos linfáticos periféricos se ven invadidos por bubones secundarios, hasta que se rompen y las células pasan de nuevo al torrente circulatorio, pero ahora en un número mucho más elevado, lo que causa una septicemia generalizada.
En este estado, se
producen múltiples hemorragias que dan lugar a manchas negras sobre la piel, procesos
de gangrena en los extremos distales de las extremidades, fuerte dolor en
nódulos linfáticos, postración, shock y delirio. Si la peste no es tratada
antes del estado septicémico, la muerte sobreviene al cabo de 3-5 días.


Peste Neumónica: Este tipo de infección se produce cuando las células de Y. pestis son inhaladas directamente, o bien llegan a los pulmones durante la peste bubónica. La infección suele transcurrir sin síntomas hasta los dos últimos días del proceso infectivo, en los cuales se emiten gran cantidad de esputos con sangre. En ausencia de tratamiento la muerte sobreviene en 2-3 días.
Peste septicémica: Esta infección implica una rápida dispersión de Y. pestis por todo el cuerpo, a través del torrente circulatorio, sin tiempo para que se formen los bubones. La muerte suele sobrevenir en 1 día, por lo que habitualmente no da tiempo a ser diagnosticada.
Las células de Y. pestis producen ciertas moléculas antigénicas que contribuyen en mayor o menor medida al proceso de la enfermedad.
- En
la pared bacteriana se encuentran unos complejos de proteína-lipoproteína,
denominados antígenos VW y F1, cuya función es evitar la fagocitosis por
parte de los macrófagos y otras células fagocíticas.
- Las
cepas virulentas de Y. pestis producen y secretan una exotoxina denominada
toxina murina (debido a su extrema toxicidad para el ratón), cuyo modo de
acción se basa en inhibir la respiración, bloqueando las reacciones de
transporte de electrones en las mitocondrias, a nivel de la coenzima Q.
Aunque no está claro que la toxina murina esté implicada en la patogénesis
de la peste humana, los síntomas que produce en el ratón son similares a
los que produce en humanos.
- Y.
pestis también produce una endotoxina altamente inmunogénica que
puede dar lugar a una potente respuesta inmune en humanos.
Y. pestis presenta resistencia natural a la penicilina, pero la mayoría de las cepas son sensibles a la estreptomicina, el cloranfenicol y las tetraciclinas. Actualmente hay ciertas evidencias de la sensibilidad de Y. pestis a gentamicina y doxiciclina. Si el tratamiento se inicia rápidamente, la mortalidad de la peste bubónica puede reducirse hasta el 1-5% de los infectados. La peste neumónica y septicémica también puede tratarse, pero suelen progresar tan rápidamente que los antibióticos siempre llegan tarde.
Bacilos Gram (-) no
fermentadores
Este gran grupo de
bacilos Gram negativos incluye a gérmenes pertenecientes a diferentes familias
y otros géneros de incierta clasificación. Pseudomonas, Flavobacterium,
Alcaligenes, Acinetobacter, son algunos de ellos, en general desprovistos de
grandes atributos de virulencia demostrables, no producen enfermedad en el
individuo sano pero pueden comportarse como oportunistas en enfermos
inmunodeprimidos.


De las numerosas
especies de Pseudomonas descritas sólo unas pocas tienen importancia en
patología humana. Pseudomonas mallei y P.pseudomallei causan enfermedad severa
en el hombre pero se aíslan raramente en el Hemisferio Occidental. Por otra
parte P. cepacia es un oportunista poco frecuentemente asociado con enfermedad
en el hombre.
Nos referiremos en
particular a la especie Pseudomonas aeruginosa por su frecuencia en patología
humana y estar mejor estudiada que otros. Es un microorganismo versátil,
ampliamente distribuido en el suelo, agua, plantas e intestino de animales.
Puede causar enfermedad en el hombre, ciertos animales, plantas e insectos.


El agua contaminada
puede ser una fuente de infección para el hombre. Es susceptible a la desecación, pero sus habilidades metabólicas le permiten sobrevivir y
multiplicarse en líquidos y ambientes húmedos de los hospitales. Sus
requerimientos nutricionales son variados, se ha aislado P. aeruginosa de aguas
termales, e incluso de soluciones desinfectantes en el hospital.
Las infecciones humanas
están la mayoría restringidas a los pacientes hospitalizados que adquieren el
microorganismo de fuentes ambientales (infección exógena) por contacto con
vectores humanos o inanimados. P. aeruginosa desarrolla bien en medios simples,
utilizándose para su aislamiento los medios de cultivo de uso corriente en el
laboratorio clínico.
La identificación de
cepas de P. aeruginosa típicamente productoras de pigmento no es difícil, pero
las cepas no pigmentadas pueden presentar un problema. La mayoría se identifican
por la producción de un pigmento, pyocyanina (Bacilo piociánico), soluble en
agua, azul, no fluorescente. P. aeruginosa produce además otro pigmento,
pyoverdina, soluble en agua, verdeamarillento, fluorescente; otras especies del
género Pseudomonas también producen pyoverdina. Otros pigmentos, menos
frecuentes pueden ser producidos por P. aeruginosa. La morfología colonial y
el olor frutado de aminoacetofenona son elementos de una identificación
sencilla, y aunque existen caracteres de identificación confirmatorios, son de
uso poco corriente.
Son bacilos Gram negativos, rectos o ligeramente curvos, móviles, con un solo flagelo polar. Oxidasa y catalasa positivas, aerobias estrictas, no fermentan glucosa, utilizan diversos azúcares oxidativamente con producción de ácido. Uno de los caracteres más constantes es su capacidad de desarrollar a 42ºC. Producen varias enzimas, proteasas, lipasas, lecitinasas.
Las defensas
inespecíficas del huésped son en general suficientes para prevenir la infección
por P. aeruginosa, pero brechas en esta barrera permiten a P. aeruginosa
invadir y causar infecciones de diversa gravedad. Producen el 10% de las
infecciones nosocomiales, infectan heridas y quemaduras y causan infecciones
pulmonares, sobre todo neumonía nosocomial e infecciones respiratorias en
pacientes con fibrosis quística.
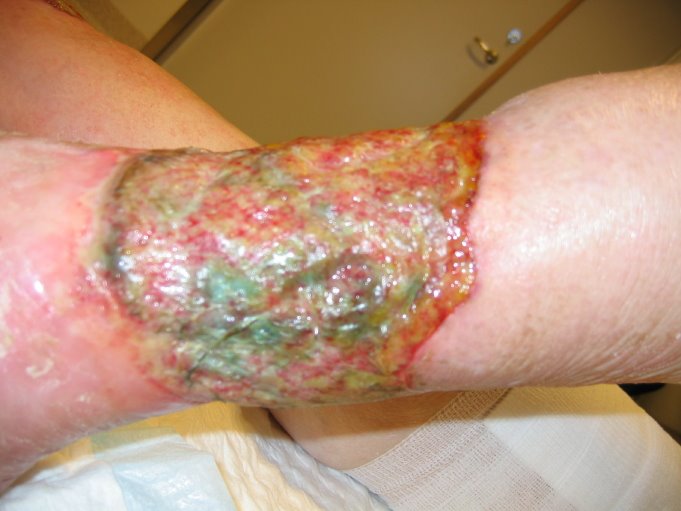
La fibrosis quística es una enfermedad genética asociada a un defecto en la secreción de cloro, caracterizada por la producción de mucina con una alteración de su composición iónica, inusualmente espesa. Esto lleva a una menor eficiencia de la mucina para limpiar las bacterias del pulmón y las vías aéreas y puede impedir el movimiento de las células fagocíticas. Estos hechos explican la susceptibilidad de los pacientes con fibrosis quística a la colonización con P. aeruginosa. Si los enfermos son tratados los síntomas pueden desaparecer pero las bacterias permanecen, presentando infecciones recurrentes. Las condiciones del paciente se ven agravadas con la infección a P. aeruginosa por las dificultades terapéuticas que se plantean debido a su alta resistencia a los antimicrobianos.
P. aeruginosa posee
los mismos tipos de factores de virulencia que otras bacterias capaces de
causar enfermedad en el hombre inmunocompetente. Pero algo interesante es ¿por
qué P. aeruginosa no es un patógeno franco y es sólo capaz de producir
infecciones oportunistas?
Es probable que P.
aeruginosa sea ineficiente en su habilidad para llevar a cabo los primeros
pasos de la infección; puede colonizar pero no invadir piel y mucosas sanas y
tampoco dar infecciones persistentes con producción concomitante de factores
tóxicos que dañen los tejidos del huésped.

Adhesinas. Produce dos tipos de adhesinas proteicas, pili y adhesinas no pili. Los pili son pili tipo 4 similares a los de N. gonorrhoeae y se parecen también a los pili Tcp de V. cholerae. Permiten a la bacteria adherirse a las células epiteliales, preferentemente a receptores asialo-GM1. P. aeruginosa produce una neuraminidasa que saca los residuos de ácido siálico de GM1, creando sitios de unión para la pilina.
Por otra parte, P.
aeruginosa es capaz de unirse a la mucina y lo hace por medio de las adhesinas
no pili. Además del gen que codifica para la proteína estructural del pili
otros genes codifican proteínas ensambladoras y reguladoras. Exoenzima S. Es
una enzima excretada que puede actuar como exotoxina. Tiene actividad de
ADPribosilación como otras toxinas, pero aplicada en forma exógena no daña las
células del huésped.

Al igual que la toxina colérica intervienen proteínas de las células del huésped en la activación de la toxina para lograr su máxima actividad. Se sostiene que actuaría dificultando la acción de los fagocitos lo que facilitaría la sobrevida de P. aeruginosa en el torrente sanguíneo y órganos. En el pulmón actuaría inhibiendo la muerte intrafagocítica de las bacterias y promoviendo la infiltración fagocítica en el área. También puede presentar efecto tóxico directo en los pulmones.
Exotoxina A. Esta
exotoxina tiene el mismo mecanismo que la toxina diftérica. Es una toxina A-B
con tres unidades funcionales:
- dominio R (región de
unión al receptor celular),
- dominio T (región que
media la translocación de la porción enzimática al interior de la célula),
- dominio C (región
catalítica).
Los dominios R y T se
localizan en la cadena B y el dominio C en la cadena A. La cadena A es
enzimáticamente activa por ADPribosilación del factor de elongación 2 (EF-2) de
la síntesis proteica, que lo vuelve inactivo. Su receptor es una glicoproteína
de las células del hospedero. La mayoría de los aislamientos clínicos la
producen, y actuaría produciendo daño en los tejidos y disminuyendo la
actividad de los fagocitos.

Elastasas. Elastina es
el 30% de las proteínas del tejido pulmonar. Está también presente en la pared
de los vasos sanguíneos. Es responsable de las propiedades elásticas de estos
órganos que se expanden y contraen. P. aeruginosa tiene actividad elastolítica,
produce dos enzimas que actuarían concertadamente: LasA y LasB. LasA actuaría
clivando la elastina y permitiendo la acción de LasB, que es una zinc
metaloproteasa, uno de cuyos substratos es la elastina.
Estas enzimas actuarían
en las etapas tempranas de la enfermedad, por daño directo de los tejidos pero
no en infecciones crónicas, debido a la presencia de anticuerpos antielastasas.
También pueden intervenir degradando componentes del complemento e inhibidores
de 1 proteinasa (inhibe el daño de los tejidos por las proteasas de los
polimorfonucleares (PMNs)). En las infecciones crónicas, altos niveles de
anticuerpos producidos pueden llevar a la formación de complejos inmunes y su
depósito en el pulmón activar complemento y atraer PMNs. Los PMNs producen su
propia elastasa, más potente que LasA-LasB.
Pequeñas cantidades de
LasA pueden facilitar la degradación de la elastina pulmonar causada por la
elastasa de los PMNs. Otras enzimas extracelulares. Produce varias enzimas
además de las mencionadas. Una lipasa alcalina y dos fosfolipasas, no bien
estudiadas. Por otra parte, pyocianina puede funcionar como factor de
virulencia. Puede dañar el tejido endotelial in vitro, lo que sugiere una
acción in vivo.

Un atributo de
virulencia muy interesante es la producción de alginato. Es un polímero de
ácido mannurónico y gulurónico que forma un gel viscoso alrededor de la
bacteria. Las colonias que lo producen tienen aspecto mucoide. Para las
bacterias marinas esto es un atributo importante para su supervivencia. P.
aeruginosa ha adaptado esto a su supervivencia en el pulmón. En medios de
cultivo ricos pierde esta propiedad.
Esta capa que rodea a la
bacteria y a las colonias de bacterias en el pulmón puede actuar como adhesina
y probablemente previene la ingestión fagocítica de la bacteria. Los genes que
intervienen en su codificación están agrupados en un sector del cromosoma y
organizados en un operón, poseen un sistema de regulación extremadamente
complejo.
El LPS también varía
durante la transición mucoide – no mucoide. En cepas no mucoides el antígeno O
del LPS tiene cadenas largas y carga negativa mientras que las cepas mucoides
tienen cadenas más cortas y una composición de azúcares que lo hacen mucho más
neutro; esto sería importante en la alta resistencia a algunos antibióticos que
presenta P. aeruginosa, situación problemática en pacientes internados, pero
dramática en los pacientes con fibrosis quística, que muchas veces presentan
infecciones por P. aeruginosa resistente a todos los antibióticos disponibles.



Desde mi punto de vista muy completo para el área de inocuidad de los alimentos.
ResponderBorrarAunque en algunas partes me parece que las ideas no se cierran de manera adecuada.
Le agradezco su generosa respuesta. es un blog resumen de mis libros personales. La invito a aportar sus conocimientos para cerrar adecuadamente las ideas que considere pertinentes, buena jornada.
Borrar