Guía Práctica del laboratorio microbiológico en agua y alimentos (Parte III)
"Lo poco que hoy soy, lo soy en razón de todo lo que he aprendido"
(El Autor)
GUÍA PRACTICA del LABORATORIO MICROBIOLOGICO
en AGUA y ALIMENTOS (Parte III)
Metabolismo
bacteriano y factores que inciden en su normal desarrollo
Las
bacterias que pueden presentarse en el agua de consumo y en los alimentos
crudos y/o cocidos, son microorganismos de una organización celular simple y se
encuentran solos o agrupados; constan de una pared rígida que además de otorgar
una forma característica para cada familia bacteriana, le permitirá a las
mismas colorearse o no con determinadas substancias que nos orientarán a priori
sobre qué género de bacteria está contaminando la muestra. Dichos
contaminantes, bajo condiciones favorables de pH, temperatura y nutrientes,
desarrollan un crecimiento explosivo. Amplios grupos de microorganismos, pueden
atacar a alimentos mono y disacáridos y además casi todos desarrollan en estrechos
rangos de pH que van entre los 6,60 a los 7,50 como valores extremos promedio,
excepto los mohos y levaduras que prácticamente abarcan la escala de 0 a 14.
Un alimento capaz de soportar el desarrollo de gérmenes tiene una
composición microbiana constante, únicamente, cuando ha intervenido un factor
externo (por ejemplo, congelación o deshidratación) o cuando se han agotado
todos los elementos nutritivos (alcanzando una alteración completa) o, una vez
que, la acumulación de productos metabólicos finales ha llegado a un nivel que
determina la inhibición de todo crecimiento, por ejemplo, fermentación o
adobado).

Los factores intrínsecos son inherentes a los alimentos e influyen en el crecimiento microbiano. Corresponden a características químicas, físicas y bioquímicas (nutrientes, factores antimicrobianos naturales, pH, Aw y Eh). Sus efectos combinados determinaran la selección de la porción de la flora inicial capaz de sobrevivir o crecer; los microorganismos que no pueden competir en ese ambiente, son eliminados gradualmente. Una población uniforme, después de alcanzada su estabilización, comienza a decrecer. Un estudiante de Microbiología diría que esta descripción corresponde exactamente al perfil de la curva de crecimiento bacteriano. Hasta que se llega a la etapa de estabilización, la composición cualitativa y cuantitativa de la microflora está cambiando constantemente. Cada alimento tiene, en un momento dado, un perfil microbiano característico, comenzando por la "flora inicial", correspondiente a la recolección o sacrificio, que va aumentando a lo largo del transporte, elaboración y almacenamiento. Por ejemplo, la mayor parte de las bacterias Gram (-) que originalmente se encuentran en gran cantidad en las plantaciones, no sobreviven en los frutos cítricos, debido al pH claramente desfavorable. Por lo tanto, su alteración está producida por mohos, levaduras o microorganismos Gram (+) que únicamente se encontraban en la flora inicial y en proporciones menores.
El microambiente específico de cada alimento, en particular y, las acciones estimuladoras o inhibidoras, que ejercen unos microorganismos sobre otros, influirán en el resultado final. Existen ciertas condiciones que favorecen el desarrollo de microfloras específicas e inhiben la presencia de otras; estas condiciones se traducen en factores intrínsecos, de elaboración y extrínsecos. Las bacterias responsables de las ETA (Enfermedades Transmitidas por los Alimentos) tienen una temperatura óptima de crecimiento de 37º C. Pese a todo, pueden crecer a una velocidad considerable en un rango de temperatura que se halla entre los 5º C Y 65º C. Fuera de este rango su capacidad reproductora se ve muy disminuida. A 100º C (ebullición) las bacterias comienzan a morir y por debajo de 5º C (refrigeración) su crecimiento es más lento; a los 0° C (congelación) quedan en estado latente pero no mueren.
Los factores intrínsecos son inherentes a los alimentos e influyen en el crecimiento microbiano. Corresponden a características químicas, físicas y bioquímicas (nutrientes, factores antimicrobianos naturales, pH, Aw y Eh). Sus efectos combinados determinaran la selección de la porción de la flora inicial capaz de sobrevivir o crecer; los microorganismos que no pueden competir en ese ambiente, son eliminados gradualmente. Una población uniforme, después de alcanzada su estabilización, comienza a decrecer. Un estudiante de Microbiología diría que esta descripción corresponde exactamente al perfil de la curva de crecimiento bacteriano. Hasta que se llega a la etapa de estabilización, la composición cualitativa y cuantitativa de la microflora está cambiando constantemente. Cada alimento tiene, en un momento dado, un perfil microbiano característico, comenzando por la "flora inicial", correspondiente a la recolección o sacrificio, que va aumentando a lo largo del transporte, elaboración y almacenamiento. Por ejemplo, la mayor parte de las bacterias Gram (-) que originalmente se encuentran en gran cantidad en las plantaciones, no sobreviven en los frutos cítricos, debido al pH claramente desfavorable. Por lo tanto, su alteración está producida por mohos, levaduras o microorganismos Gram (+) que únicamente se encontraban en la flora inicial y en proporciones menores.
El microambiente específico de cada alimento, en particular y, las acciones estimuladoras o inhibidoras, que ejercen unos microorganismos sobre otros, influirán en el resultado final. Existen ciertas condiciones que favorecen el desarrollo de microfloras específicas e inhiben la presencia de otras; estas condiciones se traducen en factores intrínsecos, de elaboración y extrínsecos. Las bacterias responsables de las ETA (Enfermedades Transmitidas por los Alimentos) tienen una temperatura óptima de crecimiento de 37º C. Pese a todo, pueden crecer a una velocidad considerable en un rango de temperatura que se halla entre los 5º C Y 65º C. Fuera de este rango su capacidad reproductora se ve muy disminuida. A 100º C (ebullición) las bacterias comienzan a morir y por debajo de 5º C (refrigeración) su crecimiento es más lento; a los 0° C (congelación) quedan en estado latente pero no mueren.
Los psicrótrofos: crecen a Tª de refrigeración (- 5° C) y a
óptimas de 20 – 30° C (Cl. botulinum).
Los
psicrófilos crecen a Tª de refrigeración con óptimas de 10 – 15° C
(Psicrobacter sp).
Los
mesófilos crecen entre los 30 y 40ºC (Enterobacterias).
Los
termótrofos crecen entre 42 y 50° C (Escherichia coli).
Los
termófilos crecen entre 50 y 90° C (Bacilo estearotermófilo).
Las bacterias como todos los seres vivos, necesitan alimentarse para
poder desarrollarse. Prefieren alimentos con un alto contenido de proteínas y
humedad tales como carnes rojas, pollos, pescados o productos lácteos. La
humedad del agua en algunos alimentos va de fuera a dentro o al revés. Si la
humedad relativa atmosférica es igual a la del alimento se conserva inalterado.
Si la humedad relativa del alimento es < que la humedad relativa
atmosférica el alimento se seca (Jamón de York o Jamón cocido). Si la humedad
relativa atmosférica es > que la humedad relativa del alimento: se
humedece el alimento y pueden crecen hongos (galletas, pan). Para
preservar la contaminación de los alimentos; guardar bajo condiciones
ambientales restrictivas. Cuando se almacenan bajo condiciones restrictivas se
retrasa el deterioro del alimento al reducirse el crecimiento microbiano.
Los nutrientes se han de encontrar en forma que puedan ser utilizables o degradables por los microorganismos. Algunas estructuras son resistentes al ataque microbiano y solamente pueden ser degradadas por microorganismos con enzimas específicos. La mayoría de los microorganismos alterativos no son exigentes en cuanto a sus nutrientes. Se ha venido considerando que, la alteración de los alimentos ricos en proteínas es el resultado del ataque de los enzimas bacterianos proteolíticos, que liberan aminas y péptidos de bajo peso molecular; pero actualmente se sabe que, el desarrollo microbiano en carne conservada en condiciones aeróbicas, no da lugar a una descomposición proteica significativa, hasta que no se alcanza un avanzado estado de alteración. El crecimiento bacteriano inicial se produce a expensas de la glucosa y ribosa y, continúa utilizando los lactatos y aminoácidos. Únicamente, ciertos grupos de microorganismos especiales tienen un potencial enzimático suficiente para atacar estructuras biológicas complejas y dar lugar a alteraciones. Por ejemplo, los estados de degradación iniciales de muchos tejidos vegetales, sólo pueden ser producidos por microorganismos que segregan celulasas o pectinasas. Estos enzimas despolimerizan los polisacáridos de la pared celular y liberan compuestos metabolizables de peso molecular bajo, que pueden ser utilizados por otros microorganismos.
Ciertas proteínas (queratina o elastina) son muy resistentes a la degradación por enzimas microbianos. Otras, como el colágeno, son descompuestas por la colagenasa, que sólo la producen muy pocos microorganismos (Pseudomonas sp, Clostridium perfringens y otros clostridios patógenos). Las proteínas y péptidos solubles se degradan mucho más fácilmente. Como resultado de este proceso de degradación se puede llegar a establecer un patrón particular de aminoácidos libres. Una vez que las proteínas han sido fragmentadas por la flora proteolítica, en elementos de peso molecular bajo, estos son fácilmente utilizados por la flora restante. Algunas especies liberan aminoácidos, que pueden ser asimilados por otros microorganismos, de tal modo que, llegan a establecerse asociaciones de dependencia. Otros producen péptidos de carácter estimulante. Por ejemplo, Streptococus thermophilus da lugar, en el yogur, a péptidos, que utiliza Lactobacillus bulgaricus. Muchos microorganismos alterativos (Pseudomonas y Bacillus sp), así como la mayor parte de los mohos y algunas levaduras y enterobacterias producen enzimas lipolíticas, que hidrolizan las grasas.

La proteólisis y glucólisis son actividades metabólicas esenciales de muchos organismos alterativos, mientras que, la lipólisis es menos frecuente. Existen dos razones que avalan esta idea. Primera, la proteólisis y glucólisis se llevan a cabo mucho más rápidamente, porque los sustratos de proteínas y carbohidratos son, casi siempre, solubles y, por lo tanto, más fácilmente accesibles a los enzimas microbianos intra y extracelulares. Segunda, las grasas son relativamente insolubles, por lo que las porciones directamente accesibles a los enzimas extracelulares de los microorganismos alterativos son generalmente muy pequeñas, estando inicialmente limitadas a la superficie de la monocapa de las partículas grasas. En algunas emulsiones alimentarias "agua en aceite", la distribución de los microorganismos en las gotitas grasas aisladas está hecha de tal forma que, la mayor parte del lípido no es accesible a los enzimas microbianos. De hecho, el deterioro oxidativo de las grasas está originado principalmente por factores físicos y químicos, siendo raro el enranciamiento microbiano.

No obstante, la lipólisis lenta, efectuada por los microorganismos, contribuye a la obtención de los típicos sabores de ciertos quesos (Roquefort, Gorgonzola) y de algunos productos cárnicos desecados y fermentados de forma natural, como el salame. La actividad lipásica es importante, en relación con las modificaciones del sabor, sólo como una primera etapa de una serie de reacciones. No existe correlación entre la producción de lipasas y la actividad oxidativa de los microorganismos. El contenido vitamínico de los alimentos no constituye un factor importante que pueda influir en la presentación de alteraciones, por lo que la pérdida de vitaminas en los alimentos, raramente, evita o retrasa su deterioro. No obstante, existen excepciones. Así, en los huevos los mecanismos antimicrobianos incluyen la unión de la biotina a la avidina, que disminuye la capacidad alterativa de los microorganismos. Todos los alimentos contienen minerales en cantidades excesivas, en relación con los que los microorganismos requieren para su crecimiento. En sustratos totalmente exentos de minerales no es posible el crecimiento de microorganismos y los zumos de frutas, completamente desmineralizados por intercambio iónico, son más resistentes a las levaduras que los productos no tratados.

Ciertos alimentos contienen constituyentes microbianos. Estos constituyentes se han encontrado en algunos tejidos vegetales, como especias, cebollas, ajos, berros y perejil, así como frutas (uvas). Las frambuesas contienen ácido salicílico, las bayas del fresno, ácido sórbico, y los frutos cítricos, aceites antibacterianos. Existen actividades antimicrobianas en alimentos de origen animal, sobre todo en la sangre (complemento, properdina, lisozima, histona, protamina y hematina). El calostro, leche, saliva, leucocitos y algunos otros fluidos y tejidos tienen un sistema antimicrobiano eficaz, en el que la peroxidasa ("lactoperoxidasa" de la leche) cataliza la peroxidación de sustancias de bajo peso molecular (como el tiocianato) para formar productos que inactivan a los microorganismos. Los huevos de gallina contienen lisozima, que lisa ciertas clases de bacterias. El crecimiento y multiplicación de los microorganismos están influidos por la estructura o estado físico de los alimentos; por ejemplo, el estado líquido o congelado del agua tisular, la distribución de la fase acuosa de las emulsiones y la presencia de barreras biológicas (cáscara y membranas de los huevos, escamas del pescado y piel de las aves).
La actividad antimicrobiana de los enzimas tisulares se reduce o, incluso se destruye, por tratamiento térmico. La congelación puede liberar importantes cantidades de lisozima de los tejidos animales e inhibir el crecimiento de los microorganismos, utilizados para detectar residuos de antibióticos u otras sustancias innibidoras, en la inspección de carnes. En consecuencia, se pueden obtener resultados positivos falsos. Frecuentemente, se sobrevalora la importancia de muchas actividades antimicrobianas de los alimentos. En la mayor parte de los casos, sus efectos quedan limitados a determinados grupos de microorganismos. Algunos componentes pueden anular los efectos de otros. En este sentido, ciertos cationes divalentes contrarrestan los efectos inhibidores de los ácidos grasos de cadena larga.
Los nutrientes se han de encontrar en forma que puedan ser utilizables o degradables por los microorganismos. Algunas estructuras son resistentes al ataque microbiano y solamente pueden ser degradadas por microorganismos con enzimas específicos. La mayoría de los microorganismos alterativos no son exigentes en cuanto a sus nutrientes. Se ha venido considerando que, la alteración de los alimentos ricos en proteínas es el resultado del ataque de los enzimas bacterianos proteolíticos, que liberan aminas y péptidos de bajo peso molecular; pero actualmente se sabe que, el desarrollo microbiano en carne conservada en condiciones aeróbicas, no da lugar a una descomposición proteica significativa, hasta que no se alcanza un avanzado estado de alteración. El crecimiento bacteriano inicial se produce a expensas de la glucosa y ribosa y, continúa utilizando los lactatos y aminoácidos. Únicamente, ciertos grupos de microorganismos especiales tienen un potencial enzimático suficiente para atacar estructuras biológicas complejas y dar lugar a alteraciones. Por ejemplo, los estados de degradación iniciales de muchos tejidos vegetales, sólo pueden ser producidos por microorganismos que segregan celulasas o pectinasas. Estos enzimas despolimerizan los polisacáridos de la pared celular y liberan compuestos metabolizables de peso molecular bajo, que pueden ser utilizados por otros microorganismos.
Ciertas proteínas (queratina o elastina) son muy resistentes a la degradación por enzimas microbianos. Otras, como el colágeno, son descompuestas por la colagenasa, que sólo la producen muy pocos microorganismos (Pseudomonas sp, Clostridium perfringens y otros clostridios patógenos). Las proteínas y péptidos solubles se degradan mucho más fácilmente. Como resultado de este proceso de degradación se puede llegar a establecer un patrón particular de aminoácidos libres. Una vez que las proteínas han sido fragmentadas por la flora proteolítica, en elementos de peso molecular bajo, estos son fácilmente utilizados por la flora restante. Algunas especies liberan aminoácidos, que pueden ser asimilados por otros microorganismos, de tal modo que, llegan a establecerse asociaciones de dependencia. Otros producen péptidos de carácter estimulante. Por ejemplo, Streptococus thermophilus da lugar, en el yogur, a péptidos, que utiliza Lactobacillus bulgaricus. Muchos microorganismos alterativos (Pseudomonas y Bacillus sp), así como la mayor parte de los mohos y algunas levaduras y enterobacterias producen enzimas lipolíticas, que hidrolizan las grasas.
La proteólisis y glucólisis son actividades metabólicas esenciales de muchos organismos alterativos, mientras que, la lipólisis es menos frecuente. Existen dos razones que avalan esta idea. Primera, la proteólisis y glucólisis se llevan a cabo mucho más rápidamente, porque los sustratos de proteínas y carbohidratos son, casi siempre, solubles y, por lo tanto, más fácilmente accesibles a los enzimas microbianos intra y extracelulares. Segunda, las grasas son relativamente insolubles, por lo que las porciones directamente accesibles a los enzimas extracelulares de los microorganismos alterativos son generalmente muy pequeñas, estando inicialmente limitadas a la superficie de la monocapa de las partículas grasas. En algunas emulsiones alimentarias "agua en aceite", la distribución de los microorganismos en las gotitas grasas aisladas está hecha de tal forma que, la mayor parte del lípido no es accesible a los enzimas microbianos. De hecho, el deterioro oxidativo de las grasas está originado principalmente por factores físicos y químicos, siendo raro el enranciamiento microbiano.
No obstante, la lipólisis lenta, efectuada por los microorganismos, contribuye a la obtención de los típicos sabores de ciertos quesos (Roquefort, Gorgonzola) y de algunos productos cárnicos desecados y fermentados de forma natural, como el salame. La actividad lipásica es importante, en relación con las modificaciones del sabor, sólo como una primera etapa de una serie de reacciones. No existe correlación entre la producción de lipasas y la actividad oxidativa de los microorganismos. El contenido vitamínico de los alimentos no constituye un factor importante que pueda influir en la presentación de alteraciones, por lo que la pérdida de vitaminas en los alimentos, raramente, evita o retrasa su deterioro. No obstante, existen excepciones. Así, en los huevos los mecanismos antimicrobianos incluyen la unión de la biotina a la avidina, que disminuye la capacidad alterativa de los microorganismos. Todos los alimentos contienen minerales en cantidades excesivas, en relación con los que los microorganismos requieren para su crecimiento. En sustratos totalmente exentos de minerales no es posible el crecimiento de microorganismos y los zumos de frutas, completamente desmineralizados por intercambio iónico, son más resistentes a las levaduras que los productos no tratados.
Ciertos alimentos contienen constituyentes microbianos. Estos constituyentes se han encontrado en algunos tejidos vegetales, como especias, cebollas, ajos, berros y perejil, así como frutas (uvas). Las frambuesas contienen ácido salicílico, las bayas del fresno, ácido sórbico, y los frutos cítricos, aceites antibacterianos. Existen actividades antimicrobianas en alimentos de origen animal, sobre todo en la sangre (complemento, properdina, lisozima, histona, protamina y hematina). El calostro, leche, saliva, leucocitos y algunos otros fluidos y tejidos tienen un sistema antimicrobiano eficaz, en el que la peroxidasa ("lactoperoxidasa" de la leche) cataliza la peroxidación de sustancias de bajo peso molecular (como el tiocianato) para formar productos que inactivan a los microorganismos. Los huevos de gallina contienen lisozima, que lisa ciertas clases de bacterias. El crecimiento y multiplicación de los microorganismos están influidos por la estructura o estado físico de los alimentos; por ejemplo, el estado líquido o congelado del agua tisular, la distribución de la fase acuosa de las emulsiones y la presencia de barreras biológicas (cáscara y membranas de los huevos, escamas del pescado y piel de las aves).
La actividad antimicrobiana de los enzimas tisulares se reduce o, incluso se destruye, por tratamiento térmico. La congelación puede liberar importantes cantidades de lisozima de los tejidos animales e inhibir el crecimiento de los microorganismos, utilizados para detectar residuos de antibióticos u otras sustancias innibidoras, en la inspección de carnes. En consecuencia, se pueden obtener resultados positivos falsos. Frecuentemente, se sobrevalora la importancia de muchas actividades antimicrobianas de los alimentos. En la mayor parte de los casos, sus efectos quedan limitados a determinados grupos de microorganismos. Algunos componentes pueden anular los efectos de otros. En este sentido, ciertos cationes divalentes contrarrestan los efectos inhibidores de los ácidos grasos de cadena larga.
a. FACTORES
DE ELABORACIÓN
Todos
los factores que influyen en la colonización, supervivencia y crecimiento
microbiano durante la preparación de los alimentos, se denominan factores de
elaboración. Estos factores pueden inhibir o, incluso destruir, parte o la
totalidad de la población. Por otro lado, los componentes individuales de la
flora están, en ciertos aspectos, de tal modo favorecido que producen cambios
en el perfil microbiológico.
b. FACTORES
EXTRÍNSECOS
Están
representados por factores ambientales, como temperatura de almacenamiento,
presión de vapor del agua y presiones parciales de los gases de almacenamiento,
que seleccionan una flora particular.
c. EFECTOS
COMBINADOS
El
desarrollo microbiano determina la alteración o la enfermedad de origen
alimentario que es, a su vez, una combinación de factores intrínsecos, de
elaboración y extrínsecos, que son independientes. El desarrollo del
Clostridium botulinum tipo A, a pH 7 y 37ºC, tiene lugar a aw de 0,94, mientras
que a pH 5,3, el límite de aw para que haya crecimiento es de 0,99. Las
salmonelas proliferan a pH 5,8 y a aw de 0,971, pero si el pH es de 5, el valor
de aw tiene que ser de 0,986 o superior. Para Staphylococcus aureus se ha
señalado una interdependencia similar. Aspergillus glaucus, a pH 5 es
capaz de multiplizarse a aw, de 0,73, pero a pH 3 precisa valores de aw de 0,77
o superiores. Generalmente, la inhibición está causada por una combinación de
efectos desfavorables. La combinación de pH, ClNa (aw) y NO2Na, que incide el
crecimiento de S. aureus (cepa productora de enterotoxina A) a 35 y 15ºC, y la
acción del calor, que a 65ºC determina una supervivencia del 0,1 % pueden ser
ilustraciones del efecto inhibitorio adicional del calor, cuando se combina con
una incubación a temperatura reducida. Staphylococcus aureus, Salmonella
typhimurium y E. coli son más sensibles al NO2Na, en presencia de
ClNa a 10ºC, que a 15 – 35ºC. Con C botulinum tipos A y B (inóculo de
esporos) incubados durante 6 meses, se observa un incremento similar de la
sensibilidad frente a NO2Na, en presencia de CINa. A 20 – 25ºC
el crecimiento y la producción de toxina era similar, a 17,5ºC menos evidente
y, a 15ºC no existía crecimiento durante 2 – 3 meses. En todas las combinaciones
de ClNa y NO2Na, el desarrollo continuaba aumentando hasta los 6
meses.

d. pH
Y ACIDEZ
En
estado natural, la mayoría de los alimentos, como carnes, pescados y productos
vegetales, son ligerarnente ácidos. La mayor parte de las frutas son bastante
ácidas y solo algunos alimentos, como la clara de huevo por ejemplo, son
alcalinos. Para preservar los alimentos, durante miles de años se ha venido
aumentando su acidez, bien de manera natural, por fermentación, o artificial,
por adición de ácidos débiles, con lo que se consigue inhibir la proliferación
microbiana. La acidez puede ser un factor básico en la preservación. como en el
caso de algunos alimentos fermentados tales como el yogur, la col fermentada o
los pepinillos en vinagre, o tener un papel auxiliar, cuyo efecto se combina
con el de otros factores tales como conservadores químicos, calor o actividad
de agua (aw). La concentración de iones de hidrógeno está
representada en la definición de pH de la forma que sigue:
pH = -log10 [H+] ó pH =
log10(1/[H+])
Así
pues, el pH es el logaritmo negativo de la concentración de protones o iones
hidrógeno. En alimentos, las sustancias ácidas que interesan son casi siempre
ácidos débiles (HA) que se disocian dando lugar a H+ y aw. En
equilibrio, la relación entre [H+] [A-] y [HA] es una
constante (Ka), siendo Ka = [H+] [A-] / [HA]. Lo que
también se puede expresar como:
[H+] =Ka [HA] / [A-]
y
obteniendo el logaritmo negativo de ambos términos de la ecuación,
-log H+ = -log Ka -log[HA]
+ Iog [A-]
ó
pH = pKa + log [A-]/[HA]
Si [A-]y
[HA] son iguales, el logaritmo de su cociente es cero, y el pH = pKa. En otras
palabras, pKa = pH, cuando la concentración del ácido disociado es igual a la
del ácido no disociado. En los manuales de física y química, están tabulados
los valores de Ka y pKa de diversos ácidos. Conociendo la concentración del
ácido, el pH y el pKa ó Ka, se puede calcular la cantidad de ácido no disociado
presente en una solución.

Los ácidos fuertes tienen valores de pKa muy bajos, esto es, están casi totalmente disociados cuando estan en solución. Esto supone que aportan una [H+] proporcionalmente mayor que un ácido débil. Por ejemplo, el pH (a 25ºC) de una solución 0,1 N de HCl es 1,08, mientras que el de una solución también 0,1 N de ácido acético es 2,87. El título de acidez es la cantidad de álcali standard (habitualmente 0,1 N NaOH) que se necesita para neutralizar una solución ácida. Mide la cantidad de ion hidrógeno libre y la de ion hidrógeno liberado a partir del ácido no disociado durante la titulación. El pH de un alimento es uno de los principales factores que determinan la supervivencia y el crecimiento de los microorganismos durante el procesado, el almacenaje y la distribución. Como el efecto de algunos otros factores, de los que se habla en este volumen, depende en parte del pH y es a veces difícil separar el efecto del pH per se y el de otros factores influidos por el pH. Así por ejemplo, los microorganismos se ven afectados por el nivel de iones H+ libres (o sea, el pH per se) y además, por la concentración de ácido débil no disociado, la cual a su vez depende del pH. Los aniones de algunos ácidos débiles (del ácido acético o láctico, por ejemplo) son metabolizados dentro de la célula bacteriana, liberando H+ que acidifica el interior de la célula hasta alcanzar niveles inhibitorios. Otros aniones no son metabolizados y por tanto no acidifican el interior de la célula. El pH se determina normalmente con un pHmetro electrónico, obteniendo una precisión de aproximadamente ± 0,01 unidades de pH dentro del rango de 0 a 14. El pHmetro puede venir equipado con un electrodo de membrana de vidrio y otro electrodo de referencia, o bien con un único electrodo combinado, lo que es cada vez más frecuente. El electrodo de referencia suele ser de calomelano, con puente salino de solución saturada de cloruro potásico. Se ha hecho un estudio comparado de los diversos métodos aplicables para determinar mediante pHmetro el pH de alimentos de humedad intermedia.


Para medir el pH de una superficie húmeda (como la de filetes de carne o pescado, por ejemplo) basta con aplicar los dos electrodos con suficiente presión como para obtener una lectura en el pHmetro; la medida corresponde al pH existente en la superficie del electrodo de vidrio, mientras que el electrodo de calomelano sirve sólo para establecer contacto eléctrico. En determinadas circunstancias, por ejemplo, cuando se trata de alimentos muy ácidos o fuertemente tamponados, el título de la acidez puede ser más útil que el empleo del pHmetro. Una proporción sustancial del ácido débil en solución se encuentra en forma no disociada, por lo que no contribuye directamente al pH, que sólo indica concentración de protones, no concentración total de ácido. Como la acción bacteriostática de los ácidos débiles depende básicamente de la concentración de molécula no disociada, es necesario primero estimar el pH del alimento y después, valorar la concentración total de ácido, lo que normalmente se hace mediante titulación con 0,1 N NaOH. Durante la titulación, la dilución del ácido y el drenaje de iones H+ provocan la disociación gradual del ácido inicialmente no disociado, liberando los iones H+ restantes, que pueden así ser titulados. Muchos microorganismos pueden crecer dentro de un amplio rango de pH. Cabría suponer pues, que estas células disponen de métodos eficaces para estabilizar su pH interno. Sin embargo, se ha comprobado que el pH interior puede verse considerablemente afectado por el pH del medio exterior. Se ha estudiado esta cuestión a base de seguir el paso, a través de la membrana celular, de un ácido débil, la 5,5dimetil-2,4-oxazolidindiona (DMO). En el rango de pH entre 5 y 7, el pH interno de Escherichia coli resultó ser más alcalino que el del medio exterior y por encima de pH 7, más ácido.
Hay una serie de ácidos débiles que, a pH igual o inferior a su valor de pKa, han resultado ser potentes inhibidores del transporte de aminoácidos en Penicillium chrysogenum. Entre los compuestos que han mostrado este efecto, están el ácido sórbico, el benzoico y el propiónico; se ha sugerido que la forma no disociada de estos ácidos débiles podría difundirse libremente a través de la membrana celular, e ionizarse dentro de la célula, dando lugar a protones que acidificasen el medio interno de este organismo, que es normalmente alcalino. Efectos parecidos se han observado en diversos organismos y la eficacia práctica como conservadores de distintos ácidos no disociados, se conoce desde hace muchos años. Algunos experimentos han dado pistas sobre lo que podía ser el mecanismo por el que actúan los ácidos débiles. Freesey y Col (l973) por ejemplo, determinaron en células microbianas la relación existente entre el pH externo y el interno, empleando ácidos débiles de carácter lipofilico como conservadores; su conclusión fue que es la relación entre la tasa de pérdida de protones internos y la de rechazo de protones externos, por parte de la célula, lo que determina la magnitud del efecto inhibitorio del entorno.
Los ácidos fuertes tienen valores de pKa muy bajos, esto es, están casi totalmente disociados cuando estan en solución. Esto supone que aportan una [H+] proporcionalmente mayor que un ácido débil. Por ejemplo, el pH (a 25ºC) de una solución 0,1 N de HCl es 1,08, mientras que el de una solución también 0,1 N de ácido acético es 2,87. El título de acidez es la cantidad de álcali standard (habitualmente 0,1 N NaOH) que se necesita para neutralizar una solución ácida. Mide la cantidad de ion hidrógeno libre y la de ion hidrógeno liberado a partir del ácido no disociado durante la titulación. El pH de un alimento es uno de los principales factores que determinan la supervivencia y el crecimiento de los microorganismos durante el procesado, el almacenaje y la distribución. Como el efecto de algunos otros factores, de los que se habla en este volumen, depende en parte del pH y es a veces difícil separar el efecto del pH per se y el de otros factores influidos por el pH. Así por ejemplo, los microorganismos se ven afectados por el nivel de iones H+ libres (o sea, el pH per se) y además, por la concentración de ácido débil no disociado, la cual a su vez depende del pH. Los aniones de algunos ácidos débiles (del ácido acético o láctico, por ejemplo) son metabolizados dentro de la célula bacteriana, liberando H+ que acidifica el interior de la célula hasta alcanzar niveles inhibitorios. Otros aniones no son metabolizados y por tanto no acidifican el interior de la célula. El pH se determina normalmente con un pHmetro electrónico, obteniendo una precisión de aproximadamente ± 0,01 unidades de pH dentro del rango de 0 a 14. El pHmetro puede venir equipado con un electrodo de membrana de vidrio y otro electrodo de referencia, o bien con un único electrodo combinado, lo que es cada vez más frecuente. El electrodo de referencia suele ser de calomelano, con puente salino de solución saturada de cloruro potásico. Se ha hecho un estudio comparado de los diversos métodos aplicables para determinar mediante pHmetro el pH de alimentos de humedad intermedia.
Para medir el pH de una superficie húmeda (como la de filetes de carne o pescado, por ejemplo) basta con aplicar los dos electrodos con suficiente presión como para obtener una lectura en el pHmetro; la medida corresponde al pH existente en la superficie del electrodo de vidrio, mientras que el electrodo de calomelano sirve sólo para establecer contacto eléctrico. En determinadas circunstancias, por ejemplo, cuando se trata de alimentos muy ácidos o fuertemente tamponados, el título de la acidez puede ser más útil que el empleo del pHmetro. Una proporción sustancial del ácido débil en solución se encuentra en forma no disociada, por lo que no contribuye directamente al pH, que sólo indica concentración de protones, no concentración total de ácido. Como la acción bacteriostática de los ácidos débiles depende básicamente de la concentración de molécula no disociada, es necesario primero estimar el pH del alimento y después, valorar la concentración total de ácido, lo que normalmente se hace mediante titulación con 0,1 N NaOH. Durante la titulación, la dilución del ácido y el drenaje de iones H+ provocan la disociación gradual del ácido inicialmente no disociado, liberando los iones H+ restantes, que pueden así ser titulados. Muchos microorganismos pueden crecer dentro de un amplio rango de pH. Cabría suponer pues, que estas células disponen de métodos eficaces para estabilizar su pH interno. Sin embargo, se ha comprobado que el pH interior puede verse considerablemente afectado por el pH del medio exterior. Se ha estudiado esta cuestión a base de seguir el paso, a través de la membrana celular, de un ácido débil, la 5,5dimetil-2,4-oxazolidindiona (DMO). En el rango de pH entre 5 y 7, el pH interno de Escherichia coli resultó ser más alcalino que el del medio exterior y por encima de pH 7, más ácido.

Hay una serie de ácidos débiles que, a pH igual o inferior a su valor de pKa, han resultado ser potentes inhibidores del transporte de aminoácidos en Penicillium chrysogenum. Entre los compuestos que han mostrado este efecto, están el ácido sórbico, el benzoico y el propiónico; se ha sugerido que la forma no disociada de estos ácidos débiles podría difundirse libremente a través de la membrana celular, e ionizarse dentro de la célula, dando lugar a protones que acidificasen el medio interno de este organismo, que es normalmente alcalino. Efectos parecidos se han observado en diversos organismos y la eficacia práctica como conservadores de distintos ácidos no disociados, se conoce desde hace muchos años. Algunos experimentos han dado pistas sobre lo que podía ser el mecanismo por el que actúan los ácidos débiles. Freesey y Col (l973) por ejemplo, determinaron en células microbianas la relación existente entre el pH externo y el interno, empleando ácidos débiles de carácter lipofilico como conservadores; su conclusión fue que es la relación entre la tasa de pérdida de protones internos y la de rechazo de protones externos, por parte de la célula, lo que determina la magnitud del efecto inhibitorio del entorno.
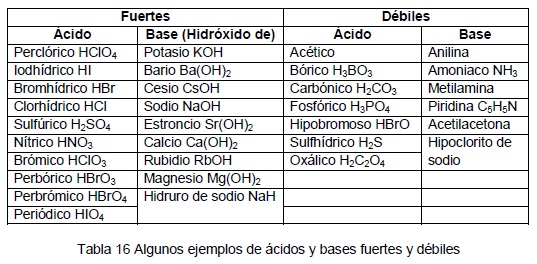
Existen
dos tipos de conservadores ácidos:
1. Los
ácidos fuertes (como el clorhídrico o el fosfórico), cuyo efecto consiste en
bajar considerablemente el pH, proporcionando una concentración externa de
protones muy elevada, que determina la acidificación del medio interno celular.
Tales condiciones son normalmente inaceptables en alimentos, pero permisibles
en bebidas carbónicas, en las que se emplea el ácido fosfórico como acidulante.
2. Los
ácidos débiles lipofílicos, que provocan la entrada de protones a través de la
membrana celular, acidificando el interior de la célula e inhibiendo el
transporte de nutrientes.
Algunos
ácidos se disocian dando lugar a aniones (lactato o citrato, por ejemplo) que
la célula es capaz de transportar y cuya presencia por tanto no inhibe el
metabolismo energético. Otros ácidos, como el acético o el fórmico, son
eficaces conservadores debido a que no sólo son buenos conductores de protones,
sino que además pueden dar lugar a concentraciones intracelulares de sus
aniones que ejercen acción inhibitoria. Los iones potenciadores de ácidos,
tales como el sulfito o el nitrito (las sales de ácidos minerales
débiles), que resultan altamente inhibitorios a pH bajo. Las células de
diferentes especies microbianas muestran muy distinta tolerancia a la
acidificación interna o a la acumulación de aniones y sus membranas presentan
distintas características en cuanto a permeabilidad de ácidos lipofílicos.
A partir de una flora mixta, la acidez puede actuar como agente selector
de un componente de la población inicial que sea particularmente tolerante. Las
levaduras y los lactobacilos resultan a menudo seleccionados por efecto de los
pHs bajos.

e. ACTIVIDAD DE AGUA REDUCIDA
Los
microorganismos requieren la presencia de agua, en una forma disponible, para
que puedan crecer y llevar a cabo sus funciones metabólicas. La mejor forma de
medir la disponibilidad de agua es mediante la actividad de agua (Aw). La aw de
un alimento puede reducirse aumentando la concentración de solutos en la fase
acuosa de los alimentos mediante la extracción del agua o mediante la adición
de solutos. Algunas moléculas del agua se orientan en tomo a las moléculas
del soluto y otras quedan absorbidas por los componentes insolubles de los
alimentos. En ambos casos, el agua queda en una forma que es menos reactiva.
La deshidratación es un método de conservación de los alimentos basado
en la reducción de la aw,lo que se consigue eliminando el agua de los productos.
Durante el curado y salazonado, así como en el almíbar y otros alimentos
azucarados son los solutos los que, al ser añadidos, descienden la aw. Un
pequeño descenso de la aw es a menudo suficiente para evitar la alteración de
los alimentos siempre que esta reducción sea potenciada por otros agentes tal
como ocurre con los nitritos en muchas carnes curadas y con los componentes del
humo en los alimentos ahumados, salazonados y desecados.

La aw de un alimento o solución se define como la relación entre la presión de vapor del agua del alimento (p) y la del agua pura (po) a la misma temperatura.
La aw de un alimento o solución se define como la relación entre la presión de vapor del agua del alimento (p) y la del agua pura (po) a la misma temperatura.
aw = p/po
A
medida que una solución se concentra. la presión de vapor disminuye y la aw va
descendiendo a partir de un valor máximo de 1 para el agua pura (en ausencia de
capilares o fuerzas de adsorción). La aw está relacionada con el punto de
congelación y con el de ebullición así como con la humedad relativa en
equilibrio (ERH) y la presión osmótica. Los primeros
estudios sobre la respuesta de los microorganismos frente a la humedad se
describieron en términos de ERH o presión osmótica. La ERH, como la aw, es la relación
entre la presión de vapor de la solución y la del agua pura pero expresadas en
porcentaje. Por ello,
ERR (%) = aw · 100
La ERH
se refiere estrictamente a la atmósfera en equilibrio con una solución o
alimento y constituye una expresión menos apropiada que la aw como forma de
medir el agua disponible. Sin embargo, los solutos nunca son ideales. De
una parte, las interacciones entre las moléculas pueden reducir el número
efectivo de partículas en la solución, mientras que de otra, la disociación
puede incrementar realmente dicho número. Tales factores
conducen a desviaciones del sistema ideal que son realmente grandes para los no
electrolitos a concentraciones superiores a 1 molal y para los electrolitos a
cualquier concentración. Las concentraciones se expresan en grados Baumé, Salometer y
Brix que son los términos más ampliamente utilizados en la Industria
Alimentaria. Los datos ofrecidos anteriormente permiten predecir la
aw de una solución sencilla de composición conocida pero la relación entre la
composición de un alimento y su aw es mucho más compleja. Para conocer estas
relaciones lo habitual es determinar los valores de la aw del alimento a
diferentes concentraciones de agua, los que se representan gráficamente con el
fin de obtener la isoterma de absorción de agua.
Los factores que reducen la presión
de vapor de agua en los alimentos y, por tanto, la aw son los siguientes: la
adsorción de las moléculas de agua a las superficies, las fuerzas capilares y
las sustancias disueltas que se han mencionado anteriormente. Normalmente se
acepta que la primera subida de la isoterma representa la adsorción del agua
que forma una monocapa de moléculas en los lugares de adsorción del producto
sólido. Al añadir más agua, la isoterma aumenta rápidamente de
nuevo a medida que los solutos se disuelven y se llenan los espacios
capilares. Estos fenómenos se solapan y algunos, realmente,
pueden no estar representados en la isoterma. En estos casos puede no
evidenciarse la monocapa en los alimentos que contengan poco material estructural
al mismo tiempo que las fuerzas capilares pueden tener poca influencia. Para
muchos alimentos, la isoterma obtenida por adsorción de agua a un producto seco
difiere de la hallada secando un alimento húmedo. Este efecto se denomina histéresis y la
parte divergente de las isotermas se le llama "espacio" de
histéresis.
En la práctica, la mayoría de los alimentos con una baja aw se preparan
por desorción del agua, es decir, deshidratándolos. Por ello, la isoterma de
desorción es la más importante y la histéresis no presenta problema alguno. Sin
embargo, la situación puede ser más complicada cuando se formulan ciertos
alimentos, los que poseen un grado de humedad intermedio (aw = 0,60 - 0,90) en
los que se mezclan ingredientes con valores de aw distintos. En los alimentos
que muestran un marcado grado de histéresis a altos niveles de aw, los
microorganismos pueden crecer más rápidamente, a iguales aw, en los sistemas
ajustados por desorción que en aquellos preparados por un proceso de adsorción. La
actividad de agua depende de la temperatura dado que ésta influye también sobre
la presión de vapor de agua de las soluciones pero el efecto es pequeño con la
mayoría de los solutos salvo que las soluciones sean saturadas. En tales casos,
las cantidades de algunas sustancias de la solución, y por tanto la aw, pueden
variar marcadamente con la temperatura. A temperaturas inferiores a las del
punto de congelación de una solución o alimento, la presión de vapor del agua
líquida disminuye al descender la temperatura. La aw de una solución o alimento
congelados es función de la temperatura presentando un valor de 0,953 a -5ºC;
de 0,907 a -10ºC; de 0,864 a -15ºC y de 0,823 a -20ºC. La determinación de
la aw se realiza habitualmente en el laboratorio mediante higrómetros
eléctricos o de cabello que se encuentran en el mercado o por interpolación
gráfica. En este último método, las muestras del alimento se mantienen a
temperatura constante en envases (preferentemente evacuados) que contienen
soluciones (con frecuencia saturadas) de aw conocidas. Las variaciones de
peso sufridas por las muestras en un período de varias horas se representan
gráficamente respecto a la aw de la solución control. La aw a la que la gráfica
indica que no ha habido variación en el peso es la aw del alimento.

"SOMOS LO QUE HACEMOS REPETIDAMENTE. EXCELENCIA, POR LO TANTO, NO
ES UN ACTO SINO UN HÁBITO"
ARISTOTELES
LEGALES: El autor no asume responsabilidad alguna por la descarga,
copia, distribución, modificación o alteración de los contenidos publicados,
sean propios del mismo o de terceros, los cuales pudieren estar protegidos por
Copyright, Derechos de Propiedad Intelectual, Derechos de Autor, o
relacionados. La Bibliografía del tema expuesto y el crédito fotográfico
está en poder del Autor y no se publica dada su extensión, pero se enviará por
mail al interesado que la solicitare debidamente fundamentada.



Por supuesto que para llegar a la historia de los alimentos ecológicos, hay que tomar en cuenta que se ha vivido un eventual rechazo de muchas propuestas para que se pueda llegar a lo que se conoce hoy en día. Visita OrganicMinimarket.com y compra los mejores productos bio. https://logios.biz
ResponderBorrar