Guía Práctica del laboratorio microbiológico en agua y alimentos (Parte XVI)
"Lo poco que hoy soy, lo soy en razón de todo lo que he aprendido"
(El Autor)
GUÍA PRACTICA del LABORATORIO MICROBIOLOGICO
en AGUA y ALIMENTOS (Parte XVI)
Salmonella
y Shigella
El
aislamiento e identificación de Salmonella sp. es un proceso complejo que
consta de varias fases; el recuento generalmente no se practica. Una vez tomada
la muestra del alimento (25 g, según lo normatizado en el CAA) se mezcla con un
medio de preenriquecimiento, como el caldo lactosado en una cantidad de 225 ml.
Este paso podría llegar a obviarse con aquellos alimentos que ya contengan
lactosa en su composición (farináceos, pastelería, etc). El caldo se
incuba entonces unas pocas horas (8) a 37 ºC para facilitar la recuperación de
las salmonelas lesionadas. La segunda fase implica la siembra de una muestra de
caldo en un medio de enriquecimiento que favorezca el crecimiento de las
salmonelas a la vez que restringe o inhibe por completo el desarrollo de
microorganismos competidores, como los coliformes. El término enriquecimiento
selectivo se usa con carácter general para indicar que a un microorganismo o a
un grupo de ellos se le permite crecer mientras que se inhiben los
competidores; en esencia en esta fase se busca que aumente la proporción del
microorganismo(s) requerido(s) respecto a todos los competidores. Los dos medios de
enriquecimiento corrientemente utilizados con las salmonelas son el Caldo de
Selenito – Cistina y el Caldo Tetrationato. El primero contiene selenito
sódico, como agente inhibidor, aunque la hidrólisis de la lactosa que también
forma parte del medio y que llevan a cabo muchas de las bacterias entéricas
presentes, da lugar a una caída del pH que favorece el crecimiento de las
salmonelas.
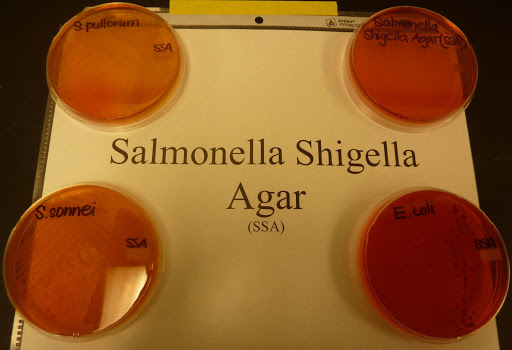
El caldo de tetrationato contiene varios agentes inhibidores como sales biliares, verde brillante y tetrationato que, en combinación, permiten que crezcan las salmonelas mientras que se inhiben eficazmente la mayoría de sus competidores. La incubación de estos caldos se realiza a 37º C durante 24 horas. Después del enriquecimiento los caldos se emplean como inóculo de placas de medios selectivos, habiéndose empleado con este fin, tanto Agar SS como Agar-rojo violeta-bilis. No obstante, ahora se usan generalmente agar de MacConkey-verde brillante y agar desoxicolato-citrato; ambos contienen diversos agentes selectivos, los nutrientes usuales, lactosa y un indicador de pH. Las salmonelas al no fermentar la lactosa forman en estos medios después de una incubación de 24 horas a 37º C, colonias verdes e incoloras, respectivamente y por lo tanto se distinguen fácilmente de las colonias rojas originadas por los microorganismos fermentadores de la lactosa. Desgraciadamente muchos otros microorganismos dan en estos medios colonias indistinguibles de las de Salmonella sp., por lo que se necesitan otras pruebas antes de confirmar su aislamiento. La confirmación se realiza picando las colonias sospechosas y después de comprobada su pureza se resiembran en medios para comprobar la fermentación de otros carbohidratos, la producción de ácido sulfhídrico, la descarboxilación de la lisina y la motilidad.

Con tal que estas pruebas de tamizado (screening) produzcan los debidos resultados, las bacterias aisladas pueden considerarse como salmonelas, llevando a cabo la confirmación final con pruebas serológicas. La caracterización del serotipo específico puede hacerse con los correspondientes antisueros H y O, si bien para la confirmación suele ser suficiente con el empleo de antisueros polivalentes H y O (que son representantes de todos los serotipos que generalmente cabe esperar). Es probable que los concentrados de muestras necesiten ser enriquecidos previamente en agua de peptona amortiguada, para luego ser enriquecidos en caldo que contenga ya sea tetrationato, selenito, cloruro de magnesio o verde de malaquita. Estos, a su vez, pueden ser sometidos a subcultivo en medios como el verde brillante, sulfito de bismuto, agar de desoxicolata xilosa-lisina (DXL), citrato de desoxicolata o agar de MacConkey, examinándose luego las colonias sospechosas tanto bioquímica como serológicamente. Entre las pruebas de depuración bioquímica se deberá incluir: agar triple de azúcar y hierro, producción de indol, decarboxilasa y actividad de ß-galactosidasa. En las pruebas serológicas se incluirá la aglutinación con sueros polivalentes anti-o, anti-H y anti-Vi.

Es imprescindible la eliminación previa de cepas autoaglutinables. Cuando el análisis se realiza para detectar las S. typhi , el medio de cultivo aconsejado es la selenita F. El procedimiento de los tubos múltiples se utilizará para calcular el número de Salmonella presentes en el agua. Debido a que las bacterias coliformes y la mayoría de cepas de Proteus vulgaris son antagónicas a la Shigella, es aconsejable elegir medios enriquecidos selectivos que reduzcan al mínimo las acumulaciones de compuestos volátiles y de los subproductos obtenidos a partir de estos microorganismos antagónicos. Se puede usar caldo nutriente con un pH ajustado de 8,0 (es el nivel de pH que menos favorece el crecimiento de bacterias coliformes). También es posible obtener un buen enriquecimiento de Shigella con un medio de cultivo autocitotóxico con base en caldo de tripticasa de soja conteniendo 1 mmol/litro de 4-cloro- 2-ciclopentilfenil ß-D-galactopiranosida, 2,5 g/litro de lactosa y sustancia amortiguadora de citrato a un pH de 6,2. La incubación debe hacerse durante 6-18 horas, a una temperatura de 35°C. Estríense las culturas en agar DXL cuando hayan transcurrido 6 y 18 horas. Sométanse las colonias sospechosas a pruebas de selección bioquímica y confírmese las colonias sospechosas con antisueros de Shigella (sueros polivalentes y de tipo).

La presencia en alimentos de cualquier serotipo de Salmonella es potencialmente peligrosa como fuente de enfermedad para el hombre, bien por consumo de los alimentos o por contaminación secundaria de utensilios y equipo para el tratamiento e industrialización de otros productos. La norma microbiológica vigente para diversos alimentos (jamón cocido, fiambre de jamón, paleta cocida, fiambre de paleta, magro de cerdo cocido, fiambre de magro de cerdo, gelatinas comestibles, huevo entero pasterizado refrigerado o congelado, yema pasterizada refrigerada o congelada, huevo entero desecado, yema desecada, clara desecada, leche y productos lácteos, nata, etc.) exige la ausencia de Salmonella en 25 g.
El caldo de tetrationato contiene varios agentes inhibidores como sales biliares, verde brillante y tetrationato que, en combinación, permiten que crezcan las salmonelas mientras que se inhiben eficazmente la mayoría de sus competidores. La incubación de estos caldos se realiza a 37º C durante 24 horas. Después del enriquecimiento los caldos se emplean como inóculo de placas de medios selectivos, habiéndose empleado con este fin, tanto Agar SS como Agar-rojo violeta-bilis. No obstante, ahora se usan generalmente agar de MacConkey-verde brillante y agar desoxicolato-citrato; ambos contienen diversos agentes selectivos, los nutrientes usuales, lactosa y un indicador de pH. Las salmonelas al no fermentar la lactosa forman en estos medios después de una incubación de 24 horas a 37º C, colonias verdes e incoloras, respectivamente y por lo tanto se distinguen fácilmente de las colonias rojas originadas por los microorganismos fermentadores de la lactosa. Desgraciadamente muchos otros microorganismos dan en estos medios colonias indistinguibles de las de Salmonella sp., por lo que se necesitan otras pruebas antes de confirmar su aislamiento. La confirmación se realiza picando las colonias sospechosas y después de comprobada su pureza se resiembran en medios para comprobar la fermentación de otros carbohidratos, la producción de ácido sulfhídrico, la descarboxilación de la lisina y la motilidad.

Con tal que estas pruebas de tamizado (screening) produzcan los debidos resultados, las bacterias aisladas pueden considerarse como salmonelas, llevando a cabo la confirmación final con pruebas serológicas. La caracterización del serotipo específico puede hacerse con los correspondientes antisueros H y O, si bien para la confirmación suele ser suficiente con el empleo de antisueros polivalentes H y O (que son representantes de todos los serotipos que generalmente cabe esperar). Es probable que los concentrados de muestras necesiten ser enriquecidos previamente en agua de peptona amortiguada, para luego ser enriquecidos en caldo que contenga ya sea tetrationato, selenito, cloruro de magnesio o verde de malaquita. Estos, a su vez, pueden ser sometidos a subcultivo en medios como el verde brillante, sulfito de bismuto, agar de desoxicolata xilosa-lisina (DXL), citrato de desoxicolata o agar de MacConkey, examinándose luego las colonias sospechosas tanto bioquímica como serológicamente. Entre las pruebas de depuración bioquímica se deberá incluir: agar triple de azúcar y hierro, producción de indol, decarboxilasa y actividad de ß-galactosidasa. En las pruebas serológicas se incluirá la aglutinación con sueros polivalentes anti-o, anti-H y anti-Vi.

Es imprescindible la eliminación previa de cepas autoaglutinables. Cuando el análisis se realiza para detectar las S. typhi , el medio de cultivo aconsejado es la selenita F. El procedimiento de los tubos múltiples se utilizará para calcular el número de Salmonella presentes en el agua. Debido a que las bacterias coliformes y la mayoría de cepas de Proteus vulgaris son antagónicas a la Shigella, es aconsejable elegir medios enriquecidos selectivos que reduzcan al mínimo las acumulaciones de compuestos volátiles y de los subproductos obtenidos a partir de estos microorganismos antagónicos. Se puede usar caldo nutriente con un pH ajustado de 8,0 (es el nivel de pH que menos favorece el crecimiento de bacterias coliformes). También es posible obtener un buen enriquecimiento de Shigella con un medio de cultivo autocitotóxico con base en caldo de tripticasa de soja conteniendo 1 mmol/litro de 4-cloro- 2-ciclopentilfenil ß-D-galactopiranosida, 2,5 g/litro de lactosa y sustancia amortiguadora de citrato a un pH de 6,2. La incubación debe hacerse durante 6-18 horas, a una temperatura de 35°C. Estríense las culturas en agar DXL cuando hayan transcurrido 6 y 18 horas. Sométanse las colonias sospechosas a pruebas de selección bioquímica y confírmese las colonias sospechosas con antisueros de Shigella (sueros polivalentes y de tipo).
La presencia en alimentos de cualquier serotipo de Salmonella es potencialmente peligrosa como fuente de enfermedad para el hombre, bien por consumo de los alimentos o por contaminación secundaria de utensilios y equipo para el tratamiento e industrialización de otros productos. La norma microbiológica vigente para diversos alimentos (jamón cocido, fiambre de jamón, paleta cocida, fiambre de paleta, magro de cerdo cocido, fiambre de magro de cerdo, gelatinas comestibles, huevo entero pasterizado refrigerado o congelado, yema pasterizada refrigerada o congelada, huevo entero desecado, yema desecada, clara desecada, leche y productos lácteos, nata, etc.) exige la ausencia de Salmonella en 25 g.
a)
Enriquecimiento en medio líquido no selectivo. Homogeneizar 25 g de la muestra
con 120 ml de agua de peptona estéril, e incubar a 37ºC durante 12-24 horas.
b)
Enriquecimiento en medio líquido selectivo. Pasar 10 ml del homogeneizado
anterior a un frasco que contenga 100 ml de caldo tetrationato
(Müller-Kauffmann). Incubar a 37ºC durante 24 horas. Para detectar ciertos
serotipos que pueden no crecer adecuadamente en las condiciones anteriores,
puede realizarse un enriquecimiento selectivo complementario en otro medio
(generalmente caldo selenito cistina) incubando y también a una temperatura
distinta (43ºC).
c)
Siembra en medios sólidos selectivos. Pasar un asa de siembra del caldo de
enriquecimiento a sendas placas de medio selectivo (agar SS Salmonella-Shigella
y agar XLD) y extender el inóculo. Incubar a 37ºC durante 24 horas.
d)
Estudio de las colonias sospechosas. En agar SS las colonias típicas son
incoloras y el medio vira a amarillo, en agar XLD son rojas y transparentes.
Algunas cepas dan colonias con el centro negro.
e) Uilización de glucosa y lactosa. De las colonias sospechosas (del
agar SS o del XLD) se siembra en superficie en un tubo de agar Kligler
incubándose a 37ºC durante 24 horas. La coloración amarilla en el fondo indica
la utilización de glucosa, mientras que la de la superficie indica la de
lactosa. El fondo negro refleja la presencia de H2S.
f)
Utilización de manitol. De las colonias sospechosas (del agar SS o del XLD) se
siembra en superficie en un tubo de agar Manitol incubándose a 37ºC durante 24
horas. La coloración amarilla indica la utilización de ese azúcar.
g)
Ureasa. De las colonias sospechosas (del agar SS o del XLD) se siembra en
superficie en un tubo de agar Urea incubándose a 37ºC durante 24 horas. La
presencia de color rosa indica resultado positivo. Se consideran
Salmonella las colonias glucosa + y lactosa - en los tubos de agar hierro
de Kligler (con o sin fondo negro), manitol + y que además sean negativas
a las otras pruebas bioquímicas.
Salmonella
pertenece a la Familia Enterobactereaceae, al Género Salmonella. Salmonella y
Arizona por la homología de su DNA se le considera una sola; la nomenclatura y
clasificación no está establecida definitivamente. Bacilo GRAM (-) aerobio y
anaerobio facultativo, producen ácido a partir de la glucosa y son generalmente
aerogénicos. Se distinguen 7 distintos subgrupos, cada cual con su
fenotipo definido y son serotipificados por antígeno O somático,Vi de superficie
y antígenos flagelares fase I y II. Según última clasificación,
se establece la siguiente nomenclatura estimándose que el 99% de
los aislamientos en clínica corresponde a al subgrupo I. El período
de incubación de la enfermedad es desde las 6 hasta 48 hrs dependiendo de la
dosis infectante la que puede ser desde 15 a 20 UFC para algunos
serotipos. No
todos los serotipos son patógenos para el hombre y animales.

La incidencia de salmonelosis se ha visto incrementada en los últimos 20 años estimándose que los casos anuales van desde 740.000 a 5.000.000 de los cuales no más del 1% es detectado. Los factores más importantes para su control pasan por una adecuada educación al consumidor y por la implementación y mantención de adecuados controles de calidad por parte del laboratorio de la industria de alimentos la que preferentemente utiliza métodos rápidos para realizar screening en sus productos mediante kits rápidos los que son eficientes en detectar partidas negativas, pero en el caso de reacciones presumiblemente positivas se debe confirmar con los métodos convencionales. Una de las fuentes principales son los alimentos contaminados con este microorganismo especialmente los alimentos de origen animal y los vegetales regados con aguas contaminadas. Los alimentos se analizan para pesquisar Salmonella por las siguientes razones:

La incidencia de salmonelosis se ha visto incrementada en los últimos 20 años estimándose que los casos anuales van desde 740.000 a 5.000.000 de los cuales no más del 1% es detectado. Los factores más importantes para su control pasan por una adecuada educación al consumidor y por la implementación y mantención de adecuados controles de calidad por parte del laboratorio de la industria de alimentos la que preferentemente utiliza métodos rápidos para realizar screening en sus productos mediante kits rápidos los que son eficientes en detectar partidas negativas, pero en el caso de reacciones presumiblemente positivas se debe confirmar con los métodos convencionales. Una de las fuentes principales son los alimentos contaminados con este microorganismo especialmente los alimentos de origen animal y los vegetales regados con aguas contaminadas. Los alimentos se analizan para pesquisar Salmonella por las siguientes razones:
a.
Confirmar que este microorganismo fue el agente causal de la intoxicación
alimentaria.
b.
Determinar qué alimentos o ingredientes de alimentos son fuente de
contaminación de Salmonella.
Es la
segunda causa más común de enfermedades transmitidas por alimentos. Es
responsable de millones de casos al año de enfermedades transmitidas por
alimentos; Origen: huevos crudos y mal cocidos, pollos y carnes mal cocidas,
productos lácteos, mariscos, frutas y vegetales. Los alimentos comúnmente
asociados a intoxicaciones son:
-carne
(vacuno, cerdo, pollo),
-productos
cárneos (jamón, salame, vienesas),
-ensaladas
(papas, porotos verdes, jamón, pollo),
-productos
de pastelería (cremas) y
-productos
lácteos (queso, queso de cabra, etc).

Staphilococus aureus
Los
métodos para el examen de S. aureus pueden agruparse en dos: primero recuento
de estafilococos y segundo comprobación de la presencia de enterotoxina en el
alimento. Dado que sólo un 50 % aproximadamente de las cepas de S. aureus son
enterotoxigénicas, se deduce que en la investigación de brotes de
toxiinfecciones alimentarias el segundo método es más concluyente; además, a
partir de ciertos alimentos corrientemente se aísla un pequeño
número de S. aureus sin que ello debe considerarse peligroso. El rango de
medios selectivos, a base de agar, que se ha utilizado para la enumeración de
S. aureus en los alimentos es especialmente grande y como en el caso de C.
perfringens, la ICMSF ha realizado un estudio comparativo de algunos de los más
empleados (Rayman et al., 1978). Concluyó que el Agar de Baird – Parker era el
que mejor se comportaba. Este medio (Baird – Parker) contiene como agentes
inhibidores telurito potásico y cloruro de litio y como sistema indicador yema
de huevo. Previamente el inóculo se lleva a un medio preselectivo como lo es el
Caldo Giollitti – Cantoni adicionado con telurito de potasio como inhibidor,
incubándose 24 hs a 37° C.

Después de 24 – 48 horas de incubación a 37º C, S. aureus produce en el medio colonias negras rodeadas de una zona clara (de 2 – 5 mm de anchura); en el interior de esta zona hay otra opaca más pequeña que sólo se desarrolla en la última fase de la incubación. Estas reacciones son muy específicas de S. aureus, pero debe hacerse una prueba confirmativa (reacción de la coagulasa). La detección de enterotoxina en los extractos de alimentos o en los filtrados de cultivos aislados de los alimentos sospechosos implica normalmente procedimientos serológicos que son más sensibles y más baratos que las pruebas previamente utilizadas. Dado que las concentraciones de enterotoxina en los alimentos son muy bajas deben emplearse métodos de extracción y concentración; puesto que estas técnicas requieren mucho tiempo, últimamente se han introducido técnicas más rápidas. Los métodos de hemaglutinación y radioinmunoensayo dan los resultados en pocas horas y además no necesitan que se concentren los extractos de los alimentos. S. aureus pertenece a la familia Micrococcaceae, al Género Staphylococcus. El género Staphilococus está constituido por diecinueve especies y se diferencian de otros géneros de la familia, en base al contenido de guanina y citosina (G + C) en el DNA, composición de la pared celular y su habilidad de crecer anaeróbicamente y fermentar la glucosa bajo esas condiciones (Bergdoll, 1979, Kloos y Schleifer, 1986). Las tres especies más conocidas de Staphilococus
Después de 24 – 48 horas de incubación a 37º C, S. aureus produce en el medio colonias negras rodeadas de una zona clara (de 2 – 5 mm de anchura); en el interior de esta zona hay otra opaca más pequeña que sólo se desarrolla en la última fase de la incubación. Estas reacciones son muy específicas de S. aureus, pero debe hacerse una prueba confirmativa (reacción de la coagulasa). La detección de enterotoxina en los extractos de alimentos o en los filtrados de cultivos aislados de los alimentos sospechosos implica normalmente procedimientos serológicos que son más sensibles y más baratos que las pruebas previamente utilizadas. Dado que las concentraciones de enterotoxina en los alimentos son muy bajas deben emplearse métodos de extracción y concentración; puesto que estas técnicas requieren mucho tiempo, últimamente se han introducido técnicas más rápidas. Los métodos de hemaglutinación y radioinmunoensayo dan los resultados en pocas horas y además no necesitan que se concentren los extractos de los alimentos. S. aureus pertenece a la familia Micrococcaceae, al Género Staphylococcus. El género Staphilococus está constituido por diecinueve especies y se diferencian de otros géneros de la familia, en base al contenido de guanina y citosina (G + C) en el DNA, composición de la pared celular y su habilidad de crecer anaeróbicamente y fermentar la glucosa bajo esas condiciones (Bergdoll, 1979, Kloos y Schleifer, 1986). Las tres especies más conocidas de Staphilococus
S.
aureus
S.
epidermidis
S.
saprophyticus
Se
diferencian por su capacidad para:
*
producir coagulasa
*
fermentar el manitol (aeróbica y anaeróbicamente),
*
producir una nucleasa termoestable
*
composición de la pared celular
S.
aureus es una bacteria inmóvil, Gram positiva, esférica y usualmente agrupada
en racimos, anaerobia facultativa, catalasa positiva. Produce generalmente la
enzima coagulasa, fermenta el manitol y otros azúcares, formando ácido pero no
gas. El crecimiento ocurre en un amplio rango de temperatura 6,5 a 50ºC, siendo
el óptimo 30-40ºC. Los Staphylococcus son microorganismos que viven en estrecha
relación con el hombre y la gran mayoría de las cepas son potencialmente
capaces de causar enfermedad. Staphylococcus aureus es un microorganismo
fácilmente destruido por tratamientos térmicos con altas
temperaturas y por todos los agentes sanitizantes. Por lo cual la presencia de
esta bacteria o sus toxinas en alimentos procesados o en equipos, generalmente
indica falta de sanitización o contaminación cruzada. Los alimentos se analizan
para investigar S.aureus por las siguientes razones:
*
Confirmar que este microorganismo fue el agente causal de la intoxicación
alimentaria.
*
Determinar qué alimentos o ingredientes de alimentos son fuente de
contaminación de Staphylococcus aureus.
* Demostrar
contaminación post proceso los cuales usualmente se deben a contacto humano con
alimentos procesados o exposición del alimento a superficies inadecuadamente
sanitizadas.
Los
alimentos comúnmente asociados a intoxicaciones son:
- carne
(vacuno, cerdo, pollo),
-
productos cárneos (jamón, salame, vienesas),
-
ensaladas (papas, porotos verdes, jamón, pollo),
-
productos de pastelería (cremas)
-
productos lácteos (queso, queso de cabra, etc)
El
objetivo de realizar análisis de Recuento de S. aureus es detectar el número de
unidades formadoras de colonias (UFC) y el de realizar NMP es estimar la
densidad de bacterias S. aureus en un alimento como indicador sanitario. Se
aplica el método de recuento en placa en alimentos en los cuales se puede
detectar > 100 células /g o ml. Se aplica la técnica NMP en productos en los
cuáles el número de S. aureus es bajo, como por ejemplo en alimentos
deshidratados o congelados. También es útil en alimentos que contengan una gran
población de especies competitivas. Aunque el
género Staphylococcus está integrado por un amplio número de especies
con posibilidad de producir enterotoxinas es indudable que S.
aureus es con mucho la que presenta un mayor porcentaje de cepas
enterotoxigénicas y por lo tanto productoras de intoxicaciones por alimentos.
La presencia de estafilococos en alimentos puede deberse a una procedencia
endógena como consecuencia de infecciones de origen animal, o exógena, a partir
de manipuladores fundamentalmente. La investigación de los brotes de
intoxicación estafilocócica diagnosticadas en los últimos años señala que la
procedencia humana de estos procesos es más frecuente que la animal. Procedimiento: Preparar un
homogeneizado del alimento (10 g) en agua de peptona (90 ml) como se ha
descrito para los recuentos de microorganismos viables. Pipetear 0,1 ml del
homogeneizado inicial (1/10) y de la dilución 1/100 y depositarlo en la
superficie de sendas placas de Petri con el medio de Baird-Parker solidificado.
Extender con varilla de vidrio previamente esterilizada por inmersión en
alcohol y posterior flameado. Incubar a 37ºC durante 24 – 48 h y contar el número de
colonias que aparecen en las placas. Se consideran estafilococos sospechosos de
ser enterotoxigénicos los que dan colonias de color negro, convexas y rodeadas
de un halo más claro en el medio de Baird-Parker. Pruebas confirmativas para estos
microorganismos son la prueba de la DNAsa y la de la coagulasa. La
desoxirribonucleasa es una poderosa enzima elaborada por las cepas patógenas de
S. aureus. A partir de las colonias típicas crecidas sobre Baird-Parker se
siembra una estría sobre la superficie del agar DNAsa. Se incuba durante 24
horas a 37ºC. Sobre el crecimiento se vierte HCl 1N y se espera unos minutos a
que se produzca la reacción, que consiste en la aparición de una zona
transparente alrededor del crecimiento. En un tubo de 10 x
75 mm se vierten 0,3 ml de plasma de conejo EDTA reconstituido. Se le añade una
colonia típica y se observa a partir de los 30 minutos. La reacción es positiva
cuando el coágulo formado es firme.
Bacillus
cereus
En los
alimentos sospechosos sólo se requiere la determinación cuantitativa de B.
cereus que, para tener importancia, debe alcanzar valores grandes. Los medios
selectivos empleados para el recuento de este microorganismo llevan
frecuentemente polimixina ya que Bacillus sp., no es afectado por este
antibiótico. A menudo se les incorpora un sistema indicador a base de yema de
huevo y posiblemente manitol, junto con un indicador de pH; B. cereus se
identifica, de forma presuntiva, por la zona opaca que rodea las colonias
después de 24 horas de incubación a 37º C, zona que es igual a la observada en
S. aureus cultivado en medios con yema de huevo. B. cereus no fermenta el
manitol por lo que sus colonias son pálidas, con una coloración púrpura del
agar que las rodea, mientras que las bacterias fermentadoras del manitol dan
unas colonias amarillas.
- Son bacterias Gram positivas, familia bacillaceae
- Aerobio y anaerobio facultativo
- Esporulado: las esporas son centrales, forma elipsoide y al formarse en el interior de la célula dan lugar al hinchamiento de esta.
- Crecen entre los 10° - 48º C, la temperatura óptima es entre 28° - 35º C.
- Generalmente son móviles con flagelos perítricos.
- Poseen antígenos somáticos y flagelares y de esporas.
- Las reacciones serológicas no se usan en su identificación, ya que dan reacciones cruzadas con otros géneros.
- Los antígenos de las esporas son termoresistentes al igual que las propias esporas
- pH = 4,9 - 9,3; Aw = 0,93 - 0,95.
- Para la germinación en el momento que se agota el medio, al final de la fase exponencial ocurre la esporulación porque son menos exigentes. La germinación de las esporas es a 30º. Las esporas son moderadamente resistentes al calor. Resisten 100º durante 5-10 minutos.
Entre
las enzimas y toxinas producidas por esta bacteria, podemos
encontrar: Lecitinasa (fosfolipasa), se puede detectar porque estos
microorganismos dan lugar a una reacción típica de precipitación cuando crecen
en medios con yema de huevo. Es una sustancia que puede estar relacionada con
efectos necróticos de células intestinales. Hemolisina, produce la lisis
de glóbulos rojos, Factor letal, produce la muerte de conejos cuando se
inyectan por vía endovenosa, Factor de permeabilidad vascular, produce
alteraciones en vasos sanguineos ya que altera su permeabilidad, Toxina
necrótica, relacionada con la lecitina y produce necrosis de las células del
epitelio intestinal, Toxina emética, produce vomitos, Toxina estable
a 126º durante 90 minutos. Estable a pH 2 y 11 durante 2 horas, puede sobrevivir
en los alimentos y Factor del asa ileal de conejo, origina diarrea y
salida de líquido en experimentación. Todas estas
sustancias se producen a lo largo de la fase exponencial o al final de la misma
por las células vegetativas. Bacillus cereus, es:
- Ubicuo
- Se puede aislar frecuentemente de alimentos naturales e industrializados
- Cuando se ingiere en cantidades pequeñas no produce clínica aparente
- Se empezó a asociar a alimentos en los años 50.
- En los casos de intoxicación los alimentos pueden haber sido tratados pero si se dejan enfriar a temperatura ambiente pueden germinar las esporas, conviene enfriar con rapidez y conservar a temperatura de refrigeración.
- En la leche es frecuente que lleguen a las ubres de las vacas y si estas no son esterilizadas antes del ordeño pueden pasar a la leche, se produce la posterior germinación de las esporas y alteran la leche lo cual puede ser detectado.
- Alimentos que pueden estar implicados: pasteles con crema, carnes y verduras, sopas, salsas, ensaladas, arroz hervido. Su poder patógeno se fundamenta en:
- Toxina emética, enterotoxina, la parte activa es una sustancia de bajo peso molecular (10.000), es estable al calor (resiste 120º C durante 1 hora)
- Factor del asa ileal de conejo, enterotoxina diarreica, proteína de peso molecular 38.000 – 50.000, se inactiva por calentamiento a 56º C durante 5 minutos, es termolábil.
Síndrome
emético, náuseas y vómitos se producen al cabo de 1 – 5
horas, la diarrea no es tan frecuente.
Síndrome
diarreico, período de incubación de 8 a 10 horas, dolor abdominal y diarrea, la
clínica desaparece a las 12 – 24 horas.

En un
brote de intoxicación va a ser fácil identificarla, mientras que cuando se
encuentra en número bajo es más complicado por acciones competitivas. Las
colonias aparecen rodeadas de un halo de precipitación blanco sobre fondo
rosa-rojo-violeta, las que fermentan el manitol de color amarillo, a las 24
horas las colonias son circulares y lisas, a las 48 horas grandes y rugosas con
estrías, nº de colonias x factor de dilución = nº U.F.C. / g. Las colonias
sospechosas se transfieren a un agar nutritivo y se incuba. Sembramos
en agar para anaerobios sin glucosa ni indicador, sembramos en picadura,
se añade parafina, incubamos a 31º 24 hora, si hay crecimiento es Bacillus
cereus. aldo
glucosa sin fosfato, prueba de Voges Proskauer (VP+), detectar acetil
metil carbinol, añadir reactivos y añadir cristales de creatina para que
la reacción sea más rápida. Agar nutritivo glucosa, incubar a 31º 24-48 horas,
se realiza la tinción con fucsina y el polihidroxibutirato
(material de reserva) no se tiñe. Caldo nitrato, la prueba es positiva si hay
transformación del nitrato en nitrito. Movilidad, se siembra en agar en un
medio semisólido en picadura, si el microorganismo es móvil crece por
todo el medio. Se puede calcular el NMP cuando se sospecha que el alimento
tenga menos de 10 UFC/ml. A partir de diluciones decimales se
siembran en: caldo tripticasa a 31º durante 48 horas, de los tubos
en crecimiento se siembran en Mossel y se confirma. Como medidas de
prevención y control, observaremos:
- Evitar que se multipliquen en los alimentos
- Cocinar los alimentos antes de servirlos
- Enfriarlos rápidamente y refrigerar
- Control en los platos preparados
"SOMOS LO QUE HACEMOS REPETIDAMENTE. EXCELENCIA, POR LO TANTO, NO ES UN ACTO SINO UN HÁBITO"
ARISTOTELES
LEGALES: El autor no asume responsabilidad alguna por la descarga, copia, distribución, modificación o alteración de los contenidos publicados, sean propios del mismo o de terceros, los cuales pudieren estar protegidos por Copyright, Derechos de Propiedad Intelectual, Derechos de Autor, o relacionados. La Bibliografía del tema expuesto y el crédito fotográfico está en poder del Autor y no se publica dada su extensión, pero se enviará por mail al interesado que la solicitare debidamente fundamentada.


Comentarios
Publicar un comentario