Guía Práctica del laboratorio microbiológico en agua y alimentos (Parte XVII)
"Lo poco que hoy soy, lo soy en razón de todo lo que he aprendido"
(El Autor)
GUÍA PRACTICA del LABORATORIO MICROBIOLOGICO
en AGUA y ALIMENTOS (Parte XVII)

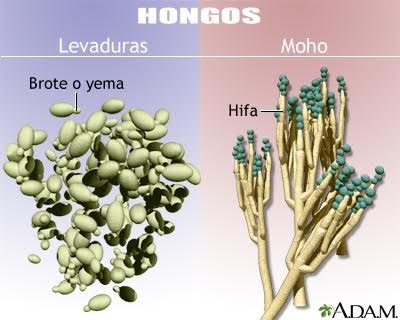
Mohos
y Levaduras
Las
levaduras y los mohos, constituyentes de la flora micótica total a investigar,
generalmente se han cultivado en medios de pH bajo (3,5 - 5,5) y a temperaturas
de 20° - 30º C si bien muchas bacterias crecen en estas condiciones. Para
inhibir las bacterias se utilizan antibióticos de «amplio espectro» que
incorporados a los medios de cultivo inhiben el crecimiento de aquéllas. Un
medio típico es el agar oxitetraciclina-glucosa-extracto de levadura, que lleva
como agente selectivo oxitetraciclina y entre otros nutrientes glucosa y que se
ajusta a un pH relativamente alto, aproximadamente 6,5. Los métodos de
ensayo de las aflatoxinas difieren algo, dependiendo del alimento. Generalmente
el alimento se pica suficientemente y a continuación se extrae con un solvente
adecuado, como el cloroformo. Se purifica el extracto y la fase siguiente de
detección implica algún tipo de cromatografía, generalmente en capa fina. Con
el empleo de solventes que separan netamente las toxinas, se pueden comparar
cualquier tipo de manchas que den fluorescencia bajo la luz UV con los
correspondientes estándares. El significado de la contaminación fúngica de los
alimentos, especialmente por mohos, viene no sólo del potencial de los mohos
para deteriorar los alimentos, sino también del potencial de muchos de ellos
para producir una gran variedad de micotoxinas a las que el hombre es sensible,
así como su capacidad para provocar infecciones e incluso, reacciones alérgicas
a personas hipersensibles a los antígenos fúngicos. En cuanto al significado
para la salud del consumidor, la acción de las levaduras es meramente
infectiva.
De
todo esto se deduce que existe un riesgo potencial en la contaminación fúngica
de los alimentos y, por ello, para conocer la calidad microbiológica de
diversos productos, se procede a la evaluación de su tasa de contaminación por
mohos y levaduras. Después del recuento se puede realizar una
identificación aproximada de las colonias de levaduras y mohos que aparecen en
la placa. La identificación de las levaduras conlleva una serie de pruebas
fisiológicas y bioquímicas, por lo que la metodología en este punto se
aproxima, en cierta medida, a los sistemas clásicos de identificación
bacteriana. Las
técnicas de identificación de mohos se encaminan, casi exclusivamente, al
estudio de la morfología, tanto macroscópica como microscópica: crecimiento,
aspecto de las colonias, características de las hifas, formación de exudado,
pigmentos, micelio, esporas, etc.
Procedimiento: La siembra de las placas de
recuento se lleva a cabo en masa. A partir de la serie de diluciones decimales
se añade 1 ml de la dilución 1/10 y 1/100 en sendas placas de Petri vacías en
las que se añade medio Rosa de Bengala con cloranfenicol (20 ml/placa aproximadamente)
atemperado a 45 - 47ºC. Las placas se incuban, SIN INVERTIRLAS, a 24ºC durante
4 - 5 días. El recuento se realiza en la placa que presente un crecimiento
entre 0 - 50 colonias. El crecimiento de mohos y levaduras se caracteriza
por el aspecto algodonoso y cremoso de sus colonias, respectivamente. Para la
identificación de mohos se coge un trozo periférico de una colonia y se
homogeneiza en un portaobjetos sobre el que previamente se ha añadido una gota
de lactofenol. Se protege la preparación con un cubre evitando que queden
burbujas de aire. Se le añade una gota de aceite de inmersión y se observan al
microscopio las esporas, los cuerpos fructíferos, el micelio, etc.

Clostridios
Sulfito – Reductores
Contrariamente
a lo que sucede con las salmonelas el aislamiento de un pequeño número de C.
perfringens a partir de los alimentos no significa necesariamente que exista
peligro de toxiinfección alimentaria; sólo cuando hay un gran número existe
verdadero peligro, por lo que con este microorganismo las técnicas de recuento
son imprescindibles. Se emplean las siembras (en placa, por vertido o «en
superficie») de diluciones de homogeneizados del alimento, junto con medios
selectivos. Se han desarrollado muchos de estos medios para C. perfringens: la
mayoría a base de agar, al que se incorporan los nutrientes más convenientes,
sistemas indicadores y agentes selectivos. La ICMSF ha estudiado
comparativamente los métodos de enumeración de C. perfringens de los alimentos
y ha concluido que el agar sulfito-cicloserina proporciona las mayores
recuperaciones de esta bacteria, además del número más bajo de falsos
positivos. Este medio contiene cicloserina, un antibiótico, y además un sistema
indicador que se basa en que C. perfringens, como otros muchos clostridios,
reduce el sulfito o sulfuro, dando colonias negras en presencia de una sal de
hierro. Después
de la incubación de las placas en anaerobiosis a 37 ºC durante 24 horas, las
colonias sospechosas se inoculan en un medio confirmativo, observando la movilidad
(C. perfringens es inmóvil) y la capacidad de reducir los nitratos a nitritos.
Otra prueba confirmatoria consiste en sembrar las colonias sospechosas en
placas de agar yema de huevo, a una de cuyas mitades se le añade antitoxina de
C. perfringens. Después de la incubación las colonias crecidas en la mitad de
la placa carente de antitoxina, están rodeadas de una zona opaca (reacción de
Nagler), mientras que las de la otra mitad no muestran cambios ya que la
reacción ha sido específicamente neutralizada por la antitoxina. C.
botulinum corrientemente no se enumera en los alimentos y las pruebas que con
él se emplean implican generalmente la detección de toxinas botulínicas en el
alimento y el aislamiento de C. botulinum, seguido de la detección de sus
toxinas.
Debe tenerse un cuidado extremo al analizar los alimentos sospechosos
y es necesario el consejo de un experto antes de embarcarse en tales
análisis. Si se dispone de buen laboratorio los homogeneizados
de alimentos se pueden examinar directamente al microscopio poniendo de
manifiesto la presencia de células enteras y de esporas con ayuda de las
técnicas de tinción fluorescente. También deben sembrarse en estría muestras de
alimentos en agar sangre, preferiblemente con yema de huevo para que
se obtenga después de una incubación de 3 días a 30º C en anaerobiosis la
típica reacción de color de C. botulinum (esto es, una zona opaca alrededor de
la colonia y una «capa perlacea» en la superficie). Las colonias sospechosas se
siembran después en caldo de carne cocida y en el líquido sobrenadante se
investiga la presencia de toxina botulínica después de un tiempo de incubación
suficiente. (el ensayo de la toxina se realiza a veces en caldo de carne
inoculado directamente con muestras del alimento sospechoso). Finalmente, en
los extractos del alimento original puede intentarse el ensayo directo de la
toxina. En esencia los ensayos implican la inoculación de los extractos del
alimento o de los sobrenadantes de los cultivos a ratones, de los que algunos
se han protegido con antitoxinas A, B o E mientras que otros no lo han sido.
Los ratones inoculados se observan algunos días y si mueren los que no se
protegieron con las correspondientes antitoxinas con los signos típicos de
botulismo, mientras que viven los que lo fueron con la antitoxina específica,
la prueba es positiva al correspondiente tipo de C. botulinum. Antes se han descrito los métodos
de aislamiento de Clostridium botulinum, C. perfringens y Bacillus cereus, pero
puede necesitarse la enumeración del número total de microorganismos
esporulados del alimento. Como medida preliminar, las muestras o diluciones que
los contengan deberán calentarse a 80º C durante 10 minutos para destruir todas
las células vegetativas, después se enfrían y siembran. El calentamiento
estimula la germinación de las esporas (choque térmico), proceso que
frecuentemente es difícil de iniciar sin un estímulo adecuado. Para el recuento
de Bacillus sp. se utilizan medios nutritivos estándar, incubándose
aeróbicamente.
Obviamente los miembros de este grupo que se encuentran en forma
vegetativa en los alimentos, no se incluyen en el recuento. Para los
clostridios se necesita incubar en jarras cerradas cuyo aire es sustituido por
hidrógeno. los clostridios anaerobios obligados requieren la inclusión en la
jarra de un catalizador, como el paladio que convierte el oxígeno residual en
agua, al combinarse con el hidrógeno. A veces se realiza un pre-enriquecimiento
preliminar de la muestra, diluida en un medio de carne cocida, sin embargo,
para verificar el recuento, es preferible la siembra directa en un medio
sólido, nutritivamente complejo. Generalmente se emplea el medio diferencial
reforzado para clostridios (Differential Reinforced Clostridial medium) de
Gibbs y Freame (1965), que aunque líquido presenta muchas ventajas. los
recuentos son mayores que en medios sólidos y no se requieren jarras
anaeróbicas. No pueden hacerse recuentos exactos pero si se inoculan diluciones
decimales se obtienen cifras que se encuentran en un rango de valores que
difieren en un factor de diez (por ej., > 1.000 pero <10.000 por g). El
medio contiene un sistema indicador a base de una fuente de azufre y una sal de
hierro, de forma que el obscurecimiento del medio indica que han crecido clostridios
la mayoría de los cuales producen ácido sulfhídrico. Las colonias de
Clostridios sulfito reductores aparecerán de color negro debido a la formación
de sulfuro ferroso por reducción del sulfito. Transcurridas 48 h, contar el
número de colonias negras desarrolladas en la totalidad de la columna de agar,
sin tener en cuenta las puntiformes. El resultado se expresará como número de
esporas de clostridios sulfito reductores en el volúmen de agua sembrado (20 ml
a 100ml). Con objeto de evitar la dificultad de recuento que puede producirse
al confluir las colonias desarrolladas se efectuará una primera lectura a las
24 h, y si por este motivo no es posible el recuento a las 48 h se dará la
lectura de las 24 h como resultado aproximado.
El grupo bacteriano
de los sulfito – reductores está integrado por microorganismos pertenecientes
al género Clostridium y que tienen en común reducir el sulfito a sulfuro. Son
muy resistentes por su capacidad de esporular. Se suelen usar para apreciar la
calidad higiénica del agua y productos animales. Su número es escaso en
productos frescos. La capacidad de esporular de estos microorganismos les
confiere una gran resistencia. La detección de Clostridium sulfito –
reductores se logra utilizando medios de cultivo en cuya fórmula interviene el
sulfito de sodio, como el medio SPS, en los que, por la capacidad de estos
microorganismos de reducir tal sustancia, se produce sulfuro de hierro al
actuar sobre el compuesto de hierro. La presencia de sulfuro de hierro se pone
de manifiesto por la aparición del color negro de las colonias.
Las
pruebas bioquímicas consisten en distintos tests químicos aplicados a medios biológicos,
los cuales, conocida su reacción, nos permiten identificar distintos
microorganismos presentes, o sea, le damos su filiación, nombre y
apellido, al microorganismo investigado. Su sistema de funcionamiento
generalmente consiste en determinar la actividad de
una vía metabólica a partir de un sustrato que se incorpora en un
medio de cultivo y que la bacteria al crecer incorpora o no. Para realizar las
pruebas bioquímicas se dispone de múltiples medios, los cuales se
deben aplicar de acuerdo a las exigencias del microorganismo en estudio.
De la amplia variedad de pruebas bioquímicas, estudiaremos los resultados que
estos test arrojan.
Objetivos
· Realizar
el experimento adecuadamente y poder identificar (aplicando éste método) a los
distintos microorganismos, a los cuales podremos darles “nombre y apellido”.
·
Debemos conocer cuáles de los test que componen
las pruebas bioquímicas son los adecuados de acuerdo a la circunstancia
que necesitemos estudiar.
·
Entender los principios bioquímicos de las pruebas.
·
Ser capaces de interpretar adecuadamente los resultados
entregados por las pruebas bioquímicas
·
Conocer el uso de las pruebas bioquímicas para la identificación
de microorganismos
·
Identificar errores de procedimiento en el laboratorio al realizar
los experimentos y poder reconocer en que partes del procedimiento se
cometió el o los errores, para así, mediante el desarrollo experimental conocer
más profundamente las pruebas bioquímicas.
PRUEBA DE LA OXIDASA
Pone de
manifiesto la presencia de enzima oxidasa en ciertos microorganismos. La
oxidasa o citocromo oxidasa es una enzima que cede electrones (H2), de un
substrato al oxígeno, en el tren de transporte electrónico. Pueden
utilizarse diversos reactivos, que son colorantes que actúan como aceptores de
electrones, pasando en este caso de forma incolora o poco coloreada, a
fuertemente teñida. El reactivo más utilizado es el clorhidrato de tetrametil-p
– fenilendiamina al 1 por 100 en agua (Reactivo de Kovacs). Existen
comercializados discos o tiras de papel impregnadas de reactivos para el
diagnóstico de oxidasa. Se coloca un trozo de papel de filtro Whatman Nº 1,
dentro de una placa de Petri y se le añaden dos a tres gotas de reactivo. Con
un asa de platino (que no sea de hierro, ya que puede dar falsos positivos),
tomar una colonia de veinticuatro horas de desarrollo, y extenderla sobre el
papel de filtro mojado. La aparición de una coloración púrpura sobre la línea de
inoculación se considera como reacción positiva. Si no hay cambio de
coloración, la prueba es negativa.
PRUEBA
DE LA CATALASA
La
catalasa es una enzima propia de la mayoría de las bacterias aerobias y
anaerobias facultativas que poseen citocromos, con la excepción
de Streptococcus. Su función es descomponer el peróxido de hidrógeno
(H202), desprendiendo oxígeno libre. La prueba se puede
realizar en porta o directamente sobre el cultivo. Se utiliza Agua
oxigenada al 3 por 100 y se toma con el ansa una colonia de 24 horas de desarrollo
y se deposita sobre un porta. Añadir con una pipeta una gota de agua
oxigenada al 3 por 100; lo que no debe hacerse es homogeneizar el asa con el
cultivo sobre una gota de H202 depositada
previamente en el porta, pues produce falsos positivos. La prueba puede realizarse también
añadiendo el agua oxigenada directamente sobre una placa que contiene un
cultivo puro. Si la colonia procede de una placa de agar sangre puede dar
falsos positivos debido a la presencia de eritrocitos, que también poseen catalasa.
Se considera la prueba positiva cuando se observa desprendimiento de burbujas
de gas (02).
PRUEBA
DE ÓXIDO – FERMENTACIÓN (O – F) O DE HUGH LEIFSON
El
medio de Hugh-Leifson es una base sin carbohidratos, a la que se puede añadir
después de esterilizarlo cualquier azúcar esterilizado previamente por
filtración. Cuando se habla de esta prueba sin especificar nada, hay que
suponer que el test se ha hecho con glucosa, así, cuando se dice que un
microorganismo es oxidante o fermentador se sobreentiende que lo es con
respecto al metabolismo de la glucosa. Esta prueba pone de manifiesto la
propiedad que tienen determinados microorganismos de actuar sobre los hidratos
de carbono por vía oxidativa o fermentativa. Las bacterias que no presentan
actividad sobre los glúcidos, dan esta prueba negativa. La prueba se
realiza en dos tubos con medio semisólido y rectos, que inicialmente son de
color verde. Se inoculan por picadura en el centro del tubo y uno de ellos se
recubre con parafina líquida estéril (que impide el contacto del medio con el
oxígeno atmosférico). El
indicador en medio ácido (el metabolismo de los
azúcares producen ácidos, tanto en presencia como en ausencia de
oxígeno) es de color amarillo. Si el microorganismo es únicamente oxidante,
después de la incubación sólo estará amarillo el medio sin cubrir con parafina,
si es oxidante y fermentador, en los dos tubos el color vira a
amarillo y si sólo puede utilizar el azúcar cuando no hay oxígeno sería
fermentador (tubo con parafina amarillo). El medio de cultivo utilizado es el
medio basal OF o de Hugh y Leifson. Inocular por picadura hasta 1/2 cm.
del fondo del tubo. Para cada microorganismo se siembran dos tubos, uno de los
cuales contiene parafina. Incubar a 37° C durante cuarenta y ocho horas o más.
Los tubos se observan diariamente hasta los catorce días. El viraje de color
azul verdoso a amarillo, indica que el microorganismo ha producido acidez a
partir del azúcar. Si dicha coloración aparece solamente en el tubo que no
está cubierto con parafina, diremos que el microorganismo actúa sobre la
glucosa (o el azúcar utilizado) de forma oxidativa (O). Si se manifiesta en
ambos, diremos que el germen es fermentativo (F).

UTILIZACIÓN DE LOS HIDRATOS DE CARBONO
Esta
prueba determina la capacidad de un microorganismo para fermentar un hidrato de
carbono específico, incorporado a un medio de cultivo base, produciendo ácido o
ácido y gas. El indicador incluido en el medio es rojo de fenol, que a pH 7,4
es de color rosa – rojizo y a pH ácido vira a amarillo. Los hidratos de
carbono más utilizados son: glucosa, lactosa, sacarosa, arabinosa, maltosa,
manosa, rafinosa, fructosa, xilosa, trehalosa, galactosa, ramnosa, melobiosa,
almidón, manitol, sorbitol, inositol, adonitol, inulina, salicina y
amigdalina. Se prepara una solución al 10 por 100 del azúcar en
agua destilada y se esteriliza por filtración y el medio de cultivo es el Caldo
base púrpura de bromocresol. Una vez preparado el medio, se intuba a razón de 10 ml. en
tubos que contengan una campana de Durham. Añadir asépticamente la solución
estéril de carbohidrato para lograr una concentración final del 1 por ciento de
azúcar. Inocular una o dos colonias con el ansa de platino y la incubación en
cada caso se realiza a 37° C durante 24 – 48 horas.
La
prueba nos permite observar:
·
Producción de ácido: Medio de color amarillo.
·
No producción de ácido: Medio de púrpura.
·
Producción de gas (CO2 + H2): La
presencia de aire dentro de la campana de Durham indica que el microorganismo
produce gas del azúcar.
PRUEBA DE LA BETA-GALACTOSIDASA
(ONPG)
Esta
prueba demuestra la presencia de la enzima beta-galactosidasa en algunos
microorganismos. Hay bacterias que a pesar de poseer enzimas hidrolizantes de
la lactosa (beta - galactosidasas), no pueden actuar sobre ella porque les
faltan las enzimas extracelulares apropiadas (permeasas). A estas bacterias se
les denomina mutantes crípticos. Para conocer si un microorganismo es
productor de betagalactosidasa, basta añadir el compuesto orgánico: O –
nitrofenil – beta – D – galactopiranósido (ONPG) que es incoloro. Si la
bacteria posee las enzimas hidrolizantes (beta – galactosidasa), el compuesto
se transforma en ortonitrofenol, un derivado cromogénico de color amarillo. Todos
los gérmenes denominados fermentadores lentos de la lactosa son
beta-galactosidasa positivos. Se utilizan discos de ONPG, de los que se puede
disponer comercializados. Preparar un inóculo muy denso en 1 ml. de solución
salina estéril, y añadir asépticamente un disco de ONPG. Se favorece la
reacción si la bacteria procede de un medio lactosado e incubar a 37° C de
veinte minutos a veinticuatro horas. Si el microorganismo es productor de
beta-galactosidasa, el líquido se volverá de color amarillo. Si queda incoloro,
indicará que el microorganismo no posee la enzima.
PRUEBA DE LA PRODUCCIÓN DE INDOL
La prueba del indol determina la capacidad de las bacterias de degradar
el triptófano dando indol. Algunas bacterias, gracias a la enzima triptofanasa
hidrolizan el aminoácido, dando indol, ácido pirúvico y amoniaco. La presencia
de indol se detecta observando la formación de una coloración rosa – roja en el
medio al añadir para-dimetilaminobenzaldehído. Se utiliza un medio de
cultivo rico en triptófano, como el agua de peptona, o, mejor aún, el agua de
triptona, pero inmerso en una matriz semisólida como el Agar SIM (Indol,
Movilidad y Sulfuro de Hidrógeno), que nos permitirá la lectura de éstas tres
pruebas simultáneas. Se
pueden utilizar dos reactivos:
1)
Reactivo de Kovacs, y
2)
Reactivo de Ehrlich.
En
nuestra experiencia preferimos el primero, pero hay autores que aconsejan el
segundo, especialmente para determinados anaerobios.
a) Reactivo
de Kovacs:
- Alcohol
amílico o isoamílico: 150 ml.
- Para-dimetilaminobenzaldehído:
10 g.
- Acido
clorhídrico concentrado: 50
ml.
Disolver
el aldehído en el alcohol y agregar lentamente el ácido con agitación
constante. El reactivo es de color amarillo y se guarda protegido de la luz y a
4° C.
b) Reactivo
de Ehrlich:
- Para-dimetilaminobenzaldehído:
2 g.
- Alcohol
etílico de 95°: 190 ml.
- Ácido
clorhídrico concentrado: 40 ml.
Se
prepara y almacena de igual modo que el reactivo de Kovacs. Inocular una o
dos colonias, con ansa de platino puntiforme, en el Agar SIM e incubar 24 – 48
horas a 37° C. Después de la incubación, añadir 5 gotas del Reactivo de
Kovacs agitando suavemente. La aparición de un anillo de color rojo en la
superficie del medio indica producción de indol. Si no se forma el anillo rojo,
se considera la prueba negativa.

PRUEBA
DE VOGES PROSKAUER Y ROJO DE METILO
Las Enterobacterias clínicamente
importantes son anaerobias facultativas, y como tales, fermentan los hidratos
de carbono. Se conocen dos sistemas de fermentación para
las Enterobacterias:
- Fermentación Acido Mixta: Producen Ácidos, CO2 y H2 , produciendo un gran descenso del pH.
- Fermentación Butilenglicolica: Producen menor cantidad de ácidos y Butilenglicol (Acetilmetilcarbinol), el descenso de pH es mucho menos importante.
Estas
dos pruebas se suelen realizar al mismo tiempo y se se siembran simultáneamente
en un mismo tubo con Caldo de Clark Lubs o Caldo Rojo de Metilo – Voges
Proskauer (RMVP) que posteriormente se dividen en dos para realizar
independientemente las pruebas. También se suelen considerar complementarias,
así ambas pruebas no dan positivo a la vez.
VOGES
PROSKAUER
Se basa
en la capacidad que poseen determinados microorganismos de producir acetil –
metil – carbinol a partir de la degradación de la glucosa mediante
la fermentación Butilenglicolica. En presencia de oxígeno y de una
solución de K(OH) al 40%, el acetil – metil – carbinol se convierte en
diacetilo, el cual, en contacto con alfa – naftol produce color rojo. Se
utiliza el Medio de Clark-Lubs o Caldo glucosa fosfato que es un medio
comercializado como Caldo RMVP. Inocular con ansa de platino, 1 o 2 colonias en
el caldo e incubar 24 – 48 horas a 37° C. Existen microorganismos que precisan
de otra temperatura de incubación o de un tiempo más prolongado. de los
resultados
Después
de la incubación añadir al caldo de cultivo 0,6 ml. de la solución de alfa –
naftol, y a continuación 0,2 ml. de la solución de hidróxido potásico agitando
unos instantes para favorecer un mayor contacto del líquido con el oxígeno del
aire. La lectura se efectúa después de diez a quince minutos de añadir los
reactivos, considerando como prueba positiva la aparición de una coloración
roja.
ROJO DE METILO
Se
funda en la capacidad que poseen algunos microorganismos de actuar sobre la
glucosa, y a través del ácido pirúvico producir una fermentación ácido mixta,
capaz de bajar el pH a una cifra igual o inferior a 4,4. Se utiliza el medio
de Clark-Lubs descrito en la prueba de Voges-Proskauer, y como reactivo la
Solución de rojo de metilo al 0,5 por 100 en alcohol de 60º. Inocular una
colonia, con ansa de platino, en el caldo e incubar un mínimo de 48 horas a 37º
C. Determinados microorganismos necesitan una incubación más
prolongada. Después de la incubación, añadir cinco gotas del reactivo al
caldo de cultivo. Se considera la prueba como positiva si aparece una
coloración roja. Una coloración amarilla la califica como negativa, y una
coloración anaranjada indica que la prueba es dudosa y que se deberá repetir.

Determina
la capacidad que poseen algunos microorganismos de utilizar como única fuente
de carbono el citrato, produciendo alcalinidad. El medio utilizado es el agar
citratado de Simmons. Se inocula en estría, en el pico de flauta, empezando
desde el fondo hasta la parte más alta e incubar a 37° C durante veinticuatro a
cuarenta y ocho horas. Son dos
los aspectos que confirman la positividad de la prueba:
a) La
observación de crecimiento sobre el pico de flauta.
b) La
variación de coloración de verde a azul, debido a la alcalinización del medio,
producida por la liberación de sodio del citrato utilizado,
sodio, que con las moléculas de agua presentes formará Na(OH).
PRUEBA DE LA UREA
Determina
la capacidad de un organismo para desdoblar la urea, en amoniaco y CO2,
por acción de la enzima ureasa. La visualización del proceso se fundamenta en
que la alcalinización producida en el medio de cultivo se detecta mediante un
indicador de pH (rojo de fenol). Se utiliza una solución de urea al 20 por 100.
Pesar 20 g. de urea deshidratada y disolverlos en 100 ml. de agua destilada. No
debe calentarse la solución ya que la urea se desnaturaliza por el calor.
Esterilizar por filtración, o utilizar erlenmeyer y agua destilada
estériles. Como medio base se utiliza el Medio Urea de
Christensen. Efectuar un inóculo denso en la zona del pico de flauta e incubar
a 37° C durante veinticuatro a cuarenta y ocho horas. Se considera la prueba positiva si
el medio adquiere una tonalidad rosada, y negativa si mantiene su coloración
inicial.
PRUEBA DE LA DNasa
Se basa
en la capacidad que poseen ciertas bacterias para hidrolizar enzimáticamente el
ácido desoxirribonucleico, produciendo una mezcla de mono y polinucleótidos. Se
utiliza el Agar DNA y como reactivo, el Ácido Clorhídrico 1 N. Sembrar una colonia
del germen a investigar sobre una placa de Agar DNA, de forma que después de la
incubación quede una estría superficial o un botón de crecimiento denso.
Incubar 24 horas a 37° C. Cubrir las placas con HCl 1N. En caso de que el germen sea
productor de DNasa, se observa una zona clara alrededor del crecimiento. En
caso negativo, el medio permanece opaco.

PRUEBA DE LAS DESCARBOXILASAS
Algunas
bacterias poseen unas enzimas descarboxilasas específicas que son
capaces de atacar el grupo carboxilo de determinados aminoácidos,
produciendo anhídrido carbónico y una amina, o diamina. Así la lisina
decarboxilasa (LDC) produce, a partir de la L – lisina: cadaverina (una
diamina) y CO2. La ornitina decarboxilasa (ODC) por acción sobre su L –
aminoácido específico da putresceína (diamina) y CO2. El aminoácido L –
arginina posee un sistema especial de transformación: primero por acción de una
decarboxilasa se transforma en un producto intermedio, la agmatina, la cual,
por una dihidrolasa pasa a putresceína y urea. Si el microorganismo es
productor de ureasa transformará a su vez la urea en amoniaco y anhídrido
carbónico. Se utiliza el universalmente conocido Medio de Möeller, que puede
utilizarse como base para incluir cada uno de los aminoácidos. La
inoculación se realiza con un inóculo liviano de veinticuatro horas de
crecimiento, se cubren los tubos con 2 ó 3 mI. de parafina estéril para evitar
que el pH varíe (incluso en el patrón) y se incuban a 37° C por hasta cuatro
días. Se considera el resultado positivo cuando se observa una
coloración púrpura turbia. Una coloración amarilla (debida a la actuación
de la bacteria sobre la glucosa dando ácido) indicará que la prueba es negativa.
PRUEBA
DE LA LISINA – HIERRO
En el
medio de cultivo (Agar Lisina Hierro), la peptona y el extracto de levadura aportan
los nutrientes para el desarrollo bacteriano. La glucosa es el hidrato de
carbono fermentable, y la lisina es el sustrato utilizado para detectar la
presencia de las enzimas decarboxilasa y deaminasa. El citrato de hierro y
amonio, y el tiosulfato de sodio, son los indicadores de la producción de ácido
sulfhídrico. El púrpura de bromocresol, es el indicador
de pH, el cual es de color amarillo a pH igual o menor a 5.2, y de color
violeta a pH igual o mayor a 6.8. Por decarboxilación de la lisina, se produce
la amina cadaverina, que alcaliniza el medio y esto produce el viraje del
indicador al color violeta. La decarboxilación de la lisina, tiene lugar en
medio ácido, por lo que es necesario que la glucosa sea previamente
fermentada. Los
microorganismos que no producen lisina decarboxilasa, pero que son
fermentadores de la glucosa, producen un viraje de la totalidad del medio de
cultivo al amarillo, pero a las 24 hs de incubación se observa el pico de color
violeta debido al consumo de las peptonas, y el fondo amarillo.
La producción
de sulfuro de hidrógeno, se visualiza por el ennegrecimiento del medio debido a
la formación de sulfuro de hierro. Las cepas de los géneros Proteus,
Providencia y algunas cepas de Morganella, desaminan la lisina, esto produce un
ácido alfa-ceto-carbónico, el cual, con la sal de hierro y bajo la influencia
del oxígeno forma un color rojizo en la superficie del medio. Se siembra por punción profunda con
aguja de inoculación, incubándose en aerobiosis, durante 24 horas a 37 °C.
-
Prueba Positiva: Pico violeta/fondo violeta.
-
Prueba Negativa: Pico violeta/fondo amarillo.
- Pico
rojizo / fondo amarillo. Esto sucede con cepas del género Proteus, Providencia
y alguna cepas de Morganella spp.
-
Prueba positiva de producción de ácido sulfhídrico: Ennegrecimiento del medio
(especialmente en el límite del pico y fondo)
|
Microorganismos
|
Color
en el pico de flauta
|
Color
en la base del tubo
|
Ennegrecimiento
del medio
|
Proteus
mirabilis ATCC 43071
|
Rojo
|
Amarillo
|
Negativo
|
Salmonella
typhimurium ATCC 14028
|
Púrpura
|
Púrpura
|
Positivo
|
Salmonella
enteritidis ATCC 13076
|
Púrpura
|
Púrpura
|
Positivo
|
Providencia
spp.
|
Rojo
|
Amarillo
|
Negativo
|
Citrobacter
freundii
|
Púrpura
|
Amarillo
|
Positivo
|
Morganella
spp.*
|
Rojo
|
Amarillo
|
Negativo
|
Edwarsiella
spp.
|
Púrpura
|
Púrpura
|
Positivo
|
Klebsiella
pneumoniae ATCC 700603
|
Púrpura
|
Púrpura
|
Negativo
|
Escherichia
coli ATCC 25922
|
Púrpura
|
Púrpura
|
Negativo
|
*Algunas
especies de Morganella spp., pueden desaminar la lisina.
PRUEBA DE MANITOL y MOVILIDAD
Se
utiliza un medio semisólido el Agar SIM para detectar la movilidad,
la producción de ácido sulfhídrico o sulfuro de hidrógeno y
el indol de las bacterias. Este medio puede contener manitol como fuente
de carbono. Si el microorganismo es capaz de usar el manitol se produce una
acidificación del medio, lo que da lugar a un viraje del indicador de pH de
rojo a amarillo. Inocular por picadura un tubo de medio semisólido
con cada uno de los distintos microorganismos aislados. Incubar 24 horas a 37°C
y observar la zona de crecimiento del microorganismo y si ha habido cambio en
la coloración del medio. El test de la movilidad se hace mirando el
desplazamiento del microorganismo. Si el crecimiento se limita a la zona
de la picadura, el microorganismo no es móvil. Si el crecimiento se
produce por todo el medio, el microorganismo es móvil.
PRUEBA DE REDUCCIÓN DEL NITRATO
Algunos
microorganismos utilizan el nitrato en una vía alternativa como fuente de
energía, reduciéndolo a nitrito o a nitrógeno libre. Esta propiedad es una
característica importante en la diferenciación de muchos grupos bacterianos. La
presencia de nitrito en el medio se demuestra añadiendo alfa – naftilamina y
ácido sulfanílico, con la formación de un compuesto rojo: el parasulfobencenoazo
– alfa – naftilamina. Utilizaremos el medio Manitol Movilidad, con los
siguientes reactivos:
Reactivo
A:
- Alfa-naftilamina: 5 g.
- Acido acético 5N al 30 por 100: csp 1.000 ml
Reactivo
B:
- Acido sulfanílico: 8 g.
- Acido acético 5N al 30 por 100: csp 1.000 ml
Mantener
los reactivos A y B en frasco oscuro y en la heladera sin congelar. Sembrar por
picadura e incubar a 37° C durante 24 – 48 horas. Añadir 0,5 ml. de
reactivo A y a continuación 0,5 ml. del reactivo B. La aparición de un color
rojo después de treinta segundos indica la presencia de nitritos en el medio.
La reducción de los nitratos puede dar otros productos más reducidos como
amoniaco, nitrógeno molecular, óxido nítrico, óxido nitroso o hidroxilamina,
dependiendo de la especie bacteriana, en tal caso, después de la adición del
reactivo, no se aprecia cambio de color en el medio. Para confirmar que el
proceso es negativo es necesario añadir una pequeña cantidad de polvo de zinc,
el cual, en caso de que existan nitratos, los reducirá a nitritos, volviendo el
medio de color rojo, e indicando consecuentemente que antes no se había
producido la reacción. Si después de la adición del polvo de zinc el color no
vira a rojo, indica que ha habido reducción y que el producto obtenido no ha
sido el nitrito.

PRUEBAS
CON AGAR TRIPLE AZÚCAR – HIERRO (Agar TSI)
Son
medios utilizados preferentemente para la diferenciación de la
familia Enterobacteriaceae. En ellos se puede determinar las
fermentaciones de los hidratos de carbono, la producción de gas y de ácido
sulfhídrico. El Agar TSI contiene tres azúcares: glucosa y sacarosa (10
por 100) y lactosa (1 por 100). Con una aguja de inoculación se toma
una colonia aislada y se siembra por picadura hasta unos 0,6 cm. del fondo. Se
retira la aguja siguiendo el mismo camino de entrada y, sin volver a cargar el
asa, se siembra en estría la superficie del pico de flauta. Incubar a 37° C
durante veinticuatro horas. Es importante respetar estos tiempos de incubación, ya que
lecturas de menor o mayor incubación pueden dar resultados falsamente positivos
o negativos. Se tendrán en cuenta los siguientes aspectos:
a)
Producción de ácido a partir de la glucosa: Se pone de manifiesto en la parte
inferior del medio al producirse un cambio de color debido al viraje del indicador
de pH que pasa de rojo-naranja a amarillo (ácido).
b)
Producción de gas a partir de la glucosa: Los gases producidos son el CO2 y
el H2, productos terminales del metabolismo de la glucosa, que se
aprecia por la aparición de burbujas en la parte inferior del medio, por una
producción de grietas en su interior o incluso por una elevación del medio que
se separa del fondo.
c)
Producción de ácido a partir de la lactosa: Se aprecia por un cambio de color
de rojo a amarillo en la parte del pico de flauta del medio.
d)
Producción de sulfhídrico: Se manifiesta por un ennegrecimiento del medio en la
línea de inoculación o sobre la capa superficial.
En
cultivos de bacterias muy productoras de SH2 a veces llega a ennegrecer todo el
medio, ocultando la reacción ácida de la parte inferior del medio (tubo), pero
si se ha formado SH2 es que existe una condición ácida en esa zona por lo que
se considerará el resultado, de la producción de ácido a partir de la glucosa,
como positivo.
PRUEBA DE LA FENILALANINA
Esta
prueba determina la capacidad de un organismo para desaminar el aminoácido
fenilalanina en ácido fenilpirúvico por su actividad enzimática de fenilalanina
desaminasa, con la consiguiente acidez resultante. Esta actividad enzimática es
característica de todas las especies del género Proteus y del
grupo Providencia por lo que se usa para separar ambos géneros de
otras Enterobacterias. Se cultiva el microorganismo en Agar fenilalanina
sembrando la superficie del pico de flauta con abundante inóculo e incubando
durante 16 horas. Seguidamente se añade 0,2 ml de una solución de cloruro
férrico al 10% de manera que inunde todo el crecimiento. La presencia de ácido
fenilpirúvico (prueba positiva) se manifiesta por la aparición de un color
característico verde oscuro o verde-azulado. La fenilalanina es un aminoácido
que por desaminación oxidativa forma un cetoácido, el ácido fenilpirúvico. Sólo
los géneros Proteus y Providencia poseen la fenilalanina desaminasa, lo que
permite diferenciarlas del resto de las Enterobacterias. La prueba de la
fenilalanina se basa en la detección del ácido fenilpirúvico luego del
desarrollo del germen en un medio que contiene fenilalanina. Para eso se agrega
cloruro férrico que forma un complejo de color verde con el ácido fenilpirúvico.
El medio de cultivo no puede contener extractos de carne o peptonas por su
contenido variable en fenilalanina.
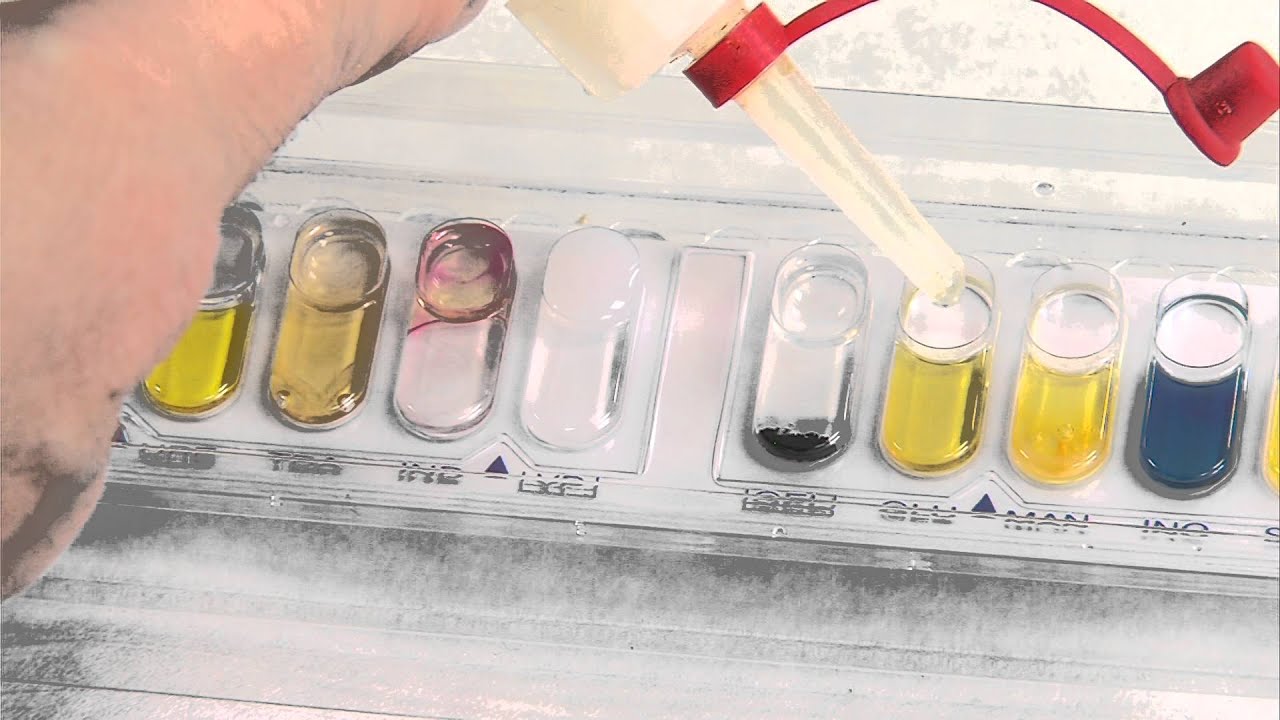
API
20E y SIMILARES
La
batería de pruebas API20E es un sistema de identificación rápida para bacterias
de la familia Enterobacteriaceae y otras bacterias Gram(-).
Básicamente consta de 23 tests bioquímicos estandarizados y miniaturizados y
una base de datos. Este sistema presenta las ventajas de ser rápido, eficaz y
de permitir realizar numerosas pruebas a la vez. Cada tira de API 20E contiene
20 microtubos o pocillos con distintos sustratos deshidratados. Cada tubo es
una prueba bioquímica. Los microtubos se inoculan con una suspensión de
microorganismos, en agua o solución salina, que rehidrata los medios. Las tiras
se incuban a 37°C y por efecto del metabolismo bacteriano se van a producir
cambios de color espontáneos o bien al añadir reactivos. La lectura de las
reacciones se hace mediante comparación con una tabla de lectura donde se
indica si los microorganismos deben considerarse positivos o negativos para
cada reacción según el color aparecido. Tomar una colonia bien aislada de
cada microorganismo y suspenderla homogéneamente en 5 ml de solución salina
(1% de ClNa) o 5 ml de agua estéril. Poner la tira en la cámara de
incubación. Previamente poner agua en los alvéolos de la cámara para
proporcionar una atmósfera húmeda durante la incubación. Cada pocillo tiene un
tubo y una cúpula. Llenar el tubo y la cúpula de los pocillos | CIT | , | VP |,
| GEL | con la suspensión de bacterias. Llenar los tubos, no la cúpula, de los
demás pocillos. Llenar con parafina las cúpulas de los pocillos ADH, LDC, ODC,
URE, H2S para obtener anaerobiosis. Incubar a 37 °C durante 18 – 24
h. La lectura de los resultados se lleva a cabo por comparación de los
colores de cada pocillo con los de la tabla de lectura. Del conjunto de
reacciones y resultados se obtiene un perfil numérico. Los pocillos están
separados en grupos de tres: en total tenemos 7 tripletes (el test número 21
corresponde al test de la oxidasa). A cada pocillo se le da el valor 0, 1, 2 o
4. Si la reacción es negativa se pone 0. Si la reacción es
positiva se pone: 1 si es el primer pocillo de un triplete, 2 si es el
segundo, 4 si es el tercero. Se suman los valores de cada triplete y
se obtiene un código de 7 cifras. Con este código se busca en la
tabla de identificación la especie de que se trata.
"SOMOS LO QUE HACEMOS REPETIDAMENTE. EXCELENCIA, POR LO TANTO, NO ES UN ACTO SINO UN HÁBITO"
ARISTOTELES
LEGALES: El autor no asume responsabilidad alguna por la descarga, copia, distribución, modificación o alteración de los contenidos publicados, sean propios del mismo o de terceros, los cuales pudieren estar protegidos por Copyright, Derechos de Propiedad Intelectual, Derechos de Autor, o relacionados. La Bibliografía del tema expuesto y el crédito fotográfico está en poder del Autor y no se publica dada su extensión, pero se enviará por mail al interesado que la solicitare debidamente fundamentada.





Comentarios
Publicar un comentario