Las Enterobacterias (Última Parte)
"La explicación más sencilla es probablemente la explicación más correcta"
(Guillermo de Ockham)
Género
Morganella
Morganella, pertenece a la familia Enterobacteriaceae y hasta el momento, presenta una sola especie: morganii. Inicialmente, Morganella morganii recibió el nombre de Proteus morganii, pero por estudios genéticos, se le sacó del género Proteus y se creó el género Morganella. Este último género, presenta un INVIC: + + - - , es capaz de hidrolizar la urea, tiene una movilidad variable a 37° C y produce ácido y gas a partir de la glucosa. Además, es capaz de reducir los nitratos a nitritos, de fermentar la manosa y como todos los integrantes de la familia Enterobacteriaceae, es oxidasa negativo. Las cepas de Morganella morganii, crecen bien en los medios de aislamiento primarios como el agar sangre y el agar MacConkey, no son hemolíticas y usualmente no producen el fenómeno de "swarming" como Proteus. En épocas recientes, se propuso la creación de una sub clasificación de este género en dos sub especies: Morganella morganii ssp. morganii y Morganella morganii ssp. sibonii. M. morganii, es causa conocida de infecciones del tracto urinario y fuera del tracto urinario, puede producir diversos tipos de infecciones. Por otra parte, se le ha relacionado como un patógeno entérico, sin embargo aquí, su papel etiológico es dudoso. En forma reciente, se documentó un caso de una corioamnionitis y sepsis asociada, caso complicado con un síndrome de distress respiratorio, además de infecciones en el recién nacido. Este agente, rara vez es causa de infecciones invasivas en personas inmunocompetentes, pero sí puede ser una causa probable de infecciones nosocomiales en personas inmunocomprometidas. Esta bacteria, presenta una resistencia intrínseca a la polimixina, ampicilina y a cefalotina y se ha documentado que es capaz de producir una beta lactamasa inducible o la beta lactamasa de efecto expandido. Todo esto, claro está, cuando el agente se ve expuesto a un agente inductor y las enzimas producidas, hidrolizan a las penicilinas y cefalosporinas de efecto expandido. Generalmente, estas bacterias dejan de producir la enzima cuando el agente inductor es removido, aún cuando, algunas cepas mutan a un estado de continua producción de beta lactamasa. Todo esto nos habla de un agente con una alta resistencia antimicrobiana, tanto natural (intrínseca) como adquirida.
Género
Providencia
Providencia
rettgeri (antes Proteus rettgeri) es una bacteria móvil perteneciente al
género Providencia, que junto a Proteus y Morganella forman la tribu
Proteae o Pro. Componente normal de la flora colónica en el hombre, se
diferencia de otras especies de Providencia en que hidroliza rápida y
abundantemente la urea pero no metaboliza a la lactosa como los otros
integrantes de Enterobacterias. Como patógeno humano se ha descripto como
causante de infecciones urinarias, sobre todo en pacientes mayores y con
catéteres uretrales, y en infecciones de heridas en pacientes inmunodeprimidos
y quemados. A diferencia de P. stuartii son muy escasas las publicaciones de
bacteriemias causadas por este microorganismo. En una revisión
bibliográfica en PubMed utilizando los términos ''Bacteriemia y Providencia
rettgeri'' aparecen sólo 2 casos de sepsis fatal en probable relación a
contaminación de hemoderivados y algún caso aislado en grandes series de
bacteriemias.

Por otra parte, Providencia alcalifaciens es un miembro bastante semejante al anterior y perteneciente también a la familia Enterobacteriaceae. Hay informes que P. alcalifaciens puede causar diarrea, pero el mecanismo por el que la causa no es bien conocido. El modelo de condensación de la actina era diferente del producido por la toxina enteropatogénica de Escherichia coli pero similar a Shigella flexneri. Se concluye que algunas algunas subespecies de P. alcalifaciens son los enteropatogénicos y que ellos causarían los cuadros de diarrea invadiendo el epitelio de la mucosa intestinal.
Por otra parte, Providencia alcalifaciens es un miembro bastante semejante al anterior y perteneciente también a la familia Enterobacteriaceae. Hay informes que P. alcalifaciens puede causar diarrea, pero el mecanismo por el que la causa no es bien conocido. El modelo de condensación de la actina era diferente del producido por la toxina enteropatogénica de Escherichia coli pero similar a Shigella flexneri. Se concluye que algunas algunas subespecies de P. alcalifaciens son los enteropatogénicos y que ellos causarían los cuadros de diarrea invadiendo el epitelio de la mucosa intestinal.
Este
género comprende varias especies entre ellas Yersinia pestis, agente de la
Peste Negra o Plaga Bubónica o Neumónica, comúnmente llamada la
Muerte Negra, enfermedad de los roedores, transmitida ocasionalmente
al hombre por las pulgas, con pandemias históricas desde el siglo VI, donde
mató a un tercio de la población en Europa. Luego de la Edad Media ha
habido brotes en diversas partes del mundo, sobre todo en relación con las
guerras. Se han denunciado en 1995 y comienzos de 1996 casos en India,
Madagascar y otros países africanos, en Brasil y Perú. Y. pestis es endémica en
algunas regiones tales como Irán y el oeste de Estados Unidos. Otra
especie, Y. enterocolitica es muy ubiquitaria, se ingiere con agua o alimentos
contaminados. Algunos biotipos están relacionados con enterocolitis en el
hombre. Raramente presenta infecciones sistémicas. Sin embargo, las bacterias atraviesan
con frecuencia la mucosa y se multiplican en los nódulos linfáticos
mesentéricos. Debido a los intensos dolores abdominales el cuadro puede
confundirse con apendicitis. Ocasionalmente puede haber una artritis
reactiva 2 a 6 semanas luego de la infección. Esto se ve
frecuentemente en pacientes con antígeno HLA-B27 de histocompatibilidad. Cepas
virulentas de las 2 especies poseen al menos un gran plásmido de virulencia.
Y. enterocolitica es una bacteria pequeña de forma redonda y Gram-negativa, la cual es aislada frecuentemente de los especímenes clínicos tales como las heridas, las heces fecales, el esputo o las glándulas linfáticas mesentéricas. Sin embargo, no forma parte normal de la flora humana. Por otro lado, Y. pseudotuberculosis ha sido aislada del apéndice infectado en los humanos. Ambos organismos han sido aislados frecuentemente de los animales, tales como los cerdos, las aves, los castores, los gatos y los perros. Solamente la bacteria Y. enterocolitica se ha encontrado en muestras ambientales de lagunas y lagos, y en alimentos como la carne, los helados y la leche. La mayoría de los organismos aislados no han sido catalogados como patógenos. El nombre de la enfermedad causada por este microorganismo es yersiniosis.

Existen tres especies patogénicas dentro del género Yersinia, pero sólo Y. enterocolitica y Y. pseudotuberculosis causan gastroenteritis. Hasta el momento, se han reportado muy pocos casos de brotes causados por Y. pseudotuberculosis, como por ejemplo las presentadas en Japón, donde se reportaron infecciones en humanos transmitidas por alimentos y por aguas contaminadas. La yersiniosis se caracteriza generalmente por síntomas tales como la gastroenteritis con diarrea y/o con vómito; sin embargo, la fiebre y el dolor abdominal son los síntomas que la definen. Las infecciones causadas por Yersinia son similares a la apendicitis y a la linfadenitis mesentérica, pero esta bacteria también puede causar infecciones en otras áreas como en las heridas, en las articulaciones y en el tracto urinario.

La dosis infecciosa es desconocida. La aparición de la enfermedad se da entre las 24 y 48 horas después de la ingestión, la cual es la ruta usual de infección (los alimentos y las bebidas son los vehiculos de transmisión). El diagnóstico de la yersiniosis se inicia con el aislamiento del microorganismo a partir de las heces fecales, de la sangre, o del vómito de la víctima, y a veces la muestra es tomada durante la apendicectomía. La confirmación se realiza con el aislamiento y la posterior identificación bioquímica y serológica de Y. enterocolitica, provenientes tanto del hospedero humano como del alimento ingerido. Se ha reportado que la diarrea ocurre en el 80% de los casos; y que los síntomas más confiables son el dolor abdominal y la fiebre. Dada la dificultad para el aislamiento de yersiniae de las heces fecales, muchos países dependen de la serología. Para ello, a los pacientes críticos y convalecientes se les realiza un análisis en busca del serotipo de Yersinia spp. sospechoso.

Las cepas de Y. enterocolitica se pueden encontrar en las carnes (de cerdo, la de carne de vaca, la de cordero, etc.), en las ostras, el pescado, y la leche cruda. La causa exacta de la contaminación de los alimentos es desconocida. Sin embargo, la prevalencia de este organismo en el suelo y el agua, así como también en ciertos animales como los castores, los cerdos, los conejos y las ardillas, ofrece grandes oportunidades para que este organismo ingrese a la cadena alimentaria. La falta de higiene de los manipuladores de alimentos y las técnicas de esterilización inadecuadas, además del almacenamiento inapropiado, son también importantes fuentes que contribuyen a la contaminación. Yersinia es sensible al calor y como resultado morirá durante el calentamiento (mayor a 70°C). Las principales causas de infección son el consumo de los alimentos crudos o parcialmente cocidos y así como la contaminación cruzada, que ocurre cuando los productos cocidos entran en contacto con los materiales crudos o contaminados (tablas para cortar). Por esta razón, la cocción adecuada y la higiene en el manejo de los alimentos pueden prevenir las infecciones causadas por Yersinia en una gran medida. Las poblaciones más susceptibles a la enfermedad principal y a sus posibles complicaciones son las más jóvenes, también los débiles, los ancianos y las personas que se encuentren bajo terapias inmunosupresoras. El nombre del género Yersinia viene dado por su descubridor, en 1894, Alexandre Yersin, bacteriólogo franco-suizo del Instituto Pasteur.

Originalmente, este microorganismo fue denominado Pasteurella pestis, pero en el año 1967 fue renombrado como Yersinia pestis en honor a su descubridor. Yersinia pestis es un agente infeccioso que ha sido directamente responsable de más muertes humanas que cualquier otra enfermedad infecciosa, salvo la malaria. Ha originado diversas pandemias a lo largo de la historia, entre las que cabe destacar: la Plaga de Justiniano (541-542 dC), que asoló Asia, el norte de África, Arabia y parte de Europa; la Peste Negra (1347-1351 dC), que acabó con la vida de un tercio de la población de Europa; y la Tercera Pandemia (1855-1959), que comenzó en China e India y terminó por extenderse por el resto de Asia, África y América. El papel de Y. pestis en la Peste Negra se ha debatido entre los historiadores; algunos han sugerido que la Peste Negra se propagó muy rápido para haber sido causada por Y. pestis.

Se ha encontrado ADN de Y. pestis en los dientes de aquellos que murieron de Peste Negra pero, sin embargo, cadáveres medievales que murieron de otras causas no dieron positivo a Y. pestis. Esto sugiere que Y. pestis fue un factor que contribuyó a las plagas europeas, pero probablemente no el único. Es posible que las presiones selectivas inducidas por la plaga puedan haber cambiado el modo en que el patógeno se manifiesta en humanos, seleccionándose en contra de individuos o poblaciones que eran más susceptibles.

Y. enterocolitica es una bacteria pequeña de forma redonda y Gram-negativa, la cual es aislada frecuentemente de los especímenes clínicos tales como las heridas, las heces fecales, el esputo o las glándulas linfáticas mesentéricas. Sin embargo, no forma parte normal de la flora humana. Por otro lado, Y. pseudotuberculosis ha sido aislada del apéndice infectado en los humanos. Ambos organismos han sido aislados frecuentemente de los animales, tales como los cerdos, las aves, los castores, los gatos y los perros. Solamente la bacteria Y. enterocolitica se ha encontrado en muestras ambientales de lagunas y lagos, y en alimentos como la carne, los helados y la leche. La mayoría de los organismos aislados no han sido catalogados como patógenos. El nombre de la enfermedad causada por este microorganismo es yersiniosis.

Existen tres especies patogénicas dentro del género Yersinia, pero sólo Y. enterocolitica y Y. pseudotuberculosis causan gastroenteritis. Hasta el momento, se han reportado muy pocos casos de brotes causados por Y. pseudotuberculosis, como por ejemplo las presentadas en Japón, donde se reportaron infecciones en humanos transmitidas por alimentos y por aguas contaminadas. La yersiniosis se caracteriza generalmente por síntomas tales como la gastroenteritis con diarrea y/o con vómito; sin embargo, la fiebre y el dolor abdominal son los síntomas que la definen. Las infecciones causadas por Yersinia son similares a la apendicitis y a la linfadenitis mesentérica, pero esta bacteria también puede causar infecciones en otras áreas como en las heridas, en las articulaciones y en el tracto urinario.

La dosis infecciosa es desconocida. La aparición de la enfermedad se da entre las 24 y 48 horas después de la ingestión, la cual es la ruta usual de infección (los alimentos y las bebidas son los vehiculos de transmisión). El diagnóstico de la yersiniosis se inicia con el aislamiento del microorganismo a partir de las heces fecales, de la sangre, o del vómito de la víctima, y a veces la muestra es tomada durante la apendicectomía. La confirmación se realiza con el aislamiento y la posterior identificación bioquímica y serológica de Y. enterocolitica, provenientes tanto del hospedero humano como del alimento ingerido. Se ha reportado que la diarrea ocurre en el 80% de los casos; y que los síntomas más confiables son el dolor abdominal y la fiebre. Dada la dificultad para el aislamiento de yersiniae de las heces fecales, muchos países dependen de la serología. Para ello, a los pacientes críticos y convalecientes se les realiza un análisis en busca del serotipo de Yersinia spp. sospechoso.
Las cepas de Y. enterocolitica se pueden encontrar en las carnes (de cerdo, la de carne de vaca, la de cordero, etc.), en las ostras, el pescado, y la leche cruda. La causa exacta de la contaminación de los alimentos es desconocida. Sin embargo, la prevalencia de este organismo en el suelo y el agua, así como también en ciertos animales como los castores, los cerdos, los conejos y las ardillas, ofrece grandes oportunidades para que este organismo ingrese a la cadena alimentaria. La falta de higiene de los manipuladores de alimentos y las técnicas de esterilización inadecuadas, además del almacenamiento inapropiado, son también importantes fuentes que contribuyen a la contaminación. Yersinia es sensible al calor y como resultado morirá durante el calentamiento (mayor a 70°C). Las principales causas de infección son el consumo de los alimentos crudos o parcialmente cocidos y así como la contaminación cruzada, que ocurre cuando los productos cocidos entran en contacto con los materiales crudos o contaminados (tablas para cortar). Por esta razón, la cocción adecuada y la higiene en el manejo de los alimentos pueden prevenir las infecciones causadas por Yersinia en una gran medida. Las poblaciones más susceptibles a la enfermedad principal y a sus posibles complicaciones son las más jóvenes, también los débiles, los ancianos y las personas que se encuentren bajo terapias inmunosupresoras. El nombre del género Yersinia viene dado por su descubridor, en 1894, Alexandre Yersin, bacteriólogo franco-suizo del Instituto Pasteur.
Originalmente, este microorganismo fue denominado Pasteurella pestis, pero en el año 1967 fue renombrado como Yersinia pestis en honor a su descubridor. Yersinia pestis es un agente infeccioso que ha sido directamente responsable de más muertes humanas que cualquier otra enfermedad infecciosa, salvo la malaria. Ha originado diversas pandemias a lo largo de la historia, entre las que cabe destacar: la Plaga de Justiniano (541-542 dC), que asoló Asia, el norte de África, Arabia y parte de Europa; la Peste Negra (1347-1351 dC), que acabó con la vida de un tercio de la población de Europa; y la Tercera Pandemia (1855-1959), que comenzó en China e India y terminó por extenderse por el resto de Asia, África y América. El papel de Y. pestis en la Peste Negra se ha debatido entre los historiadores; algunos han sugerido que la Peste Negra se propagó muy rápido para haber sido causada por Y. pestis.
Se ha encontrado ADN de Y. pestis en los dientes de aquellos que murieron de Peste Negra pero, sin embargo, cadáveres medievales que murieron de otras causas no dieron positivo a Y. pestis. Esto sugiere que Y. pestis fue un factor que contribuyó a las plagas europeas, pero probablemente no el único. Es posible que las presiones selectivas inducidas por la plaga puedan haber cambiado el modo en que el patógeno se manifiesta en humanos, seleccionándose en contra de individuos o poblaciones que eran más susceptibles.
- Yersinia pestis, agente de la denominada peste bubónica o peste negra, que asoló Europa a mediados del siglo XIV. Esta especie presenta tres subespecies: Y. pestis antiqua, Y pestis medievalis y Y. pestis orientalis.
- Yersinia pseudotuberculosis, agente de una enfermedad parecida a la tuberculosis que afecta a los nódulos linfáticos en animales y raramente en humanos.
- Yersinia enterocolitica, agente de ciertas infecciones intestinales (a veces también sistémicas) en humanos y animales.

El género Yersinia pertenece a las bacterias Gram-negativas aeróbicas facultativas con metabolismo fermentativo. Es un cocobacilo de tinción bipolar similar a otras Enterobacterias. Durante el proceso infeccioso genera viscosidad antifagocítica. El organismo presenta motilidad cuando es aislado, pero pierde esta capacidad mientras permanece en el mamífero huésped. La peste es una enfermedad natural de los roedores, siendo las ratas el principal reservorio de la enfermedad. Tras ser infectadas, la mayoría de las ratas mueren, pero un pequeño porcentaje consigue sobrevivir, quedando como una fuente de Y. pestis. Las ratas son infectadas a través de un vector, que en este caso es la pulga de rata (Xenopssylla cheopis). La pulga chupa la sangre de un animal infectado e ingiere a la vez células de Y. pestis, las cuales se multiplican en el intestino de la pulga y serán transmitidas a otra rata en la siguiente picadura de la pulga. La enfermedad se irá extendiendo de forma que la mortalidad entre las ratas se hace tan elevada que la pulga busca nuevos hospedadores, entre los que se encuentra el hombre. A continuación se exponen los tres tipos de infecciones a las que puede dar lugar Yersinia pestis:

Peste
bubónica: En el tipo de infección más común. Una vez que las células
bacterianas han sido introducidas mediante la picadura de una pulga dentro de
un ser humano, las células bacterianas se desplazan por el torrente sanguíneo
hasta los nódulos linfáticos donde generan pequeñas hinchazones denominadas
bubones, que están llenos de partículas bacterianas. La cápsula viscosa que
rodea a las células de Y. pestis evita que estas sean fagocitadas por los
macrófagos. En poco tiempo, los nódulos linfáticos periféricos se ven
invadidos por bubones secundarios, hasta que se rompen y las células pasan de
nuevo al torrente circulatorio, pero ahora en un número mucho más elevado, lo
que causa una septicemia generalizada. En este estado, se producen
múltiples hemorragias que dan lugar a manchas negras sobre la piel, procesos de
gangrena en los extremos distales de las extremidades, fuerte dolor en nódulos
linfáticos, postración, shock y delirio. Si la peste no es tratada antes del
estado septicémico, la muerte sobreviene al cabo de 3-5 días.
Peste
Neumónica: Este tipo de infección se produce cuando las células de Y.
pestis son inhaladas directamente, o bien llegan a los pulmones durante la
peste bubónica. La infección suele transcurrir sin síntomas hasta los dos
últimos días del proceso infectivo, en los cuales se emiten gran cantidad de
esputos con sangre. En ausencia de tratamiento la muerte sobreviene en 2-3
días.
Peste
septicémica: Esta infección implica una rápida dispersión de Y. pestis por
todo el cuerpo, a través del torrente circulatorio, sin tiempo para que se
formen los bubones. La muerte suele sobrevenir en 1 día, por lo que
habitualmente no da tiempo a ser diagnosticada.
Las
células de Y. pestis producen ciertas moléculas antigénicas que contribuyen en
mayor o menor medida al proceso de la enfermedad.
- En la pared bacteriana se encuentran unos complejos de proteína-lipoproteína, denominados antígenos VW y F1, cuya función es evitar la fagocitosis por parte de los macrófagos y otras células fagocíticas.
- Las cepas virulentas de Y. pestis producen y secretan una exotoxina denominada toxina murina (debido a su extrema toxicidad para el ratón), cuyo modo de acción se basa en inhibir la respiración, bloqueando las reacciones de transporte de electrones en las mitocondrias, a nivel de la coenzima Q. Aunque no está claro que la toxina murina esté implicada en la patogénesis de la peste humana, los síntomas que produce en el ratón son similares a los que produce en humanos.
- Y. pestis también produce una endotoxina altamente inmunogénica que puede dar lugar a una potente respuesta inmune en humanos.
Bacilos
Gram (-) no fermentadores
Este
gran grupo de bacilos Gram negativos incluye a gérmenes pertenecientes a
diferentes familias y otros géneros de incierta clasificación. Pseudomonas,
Flavobacterium, Alcaligenes, Acinetobacter, son algunos de ellos, en general
desprovistos de grandes atributos de virulencia demostrables, no producen
enfermedad en el individuo sano pero pueden comportarse como oportunistas en
enfermos inmunodeprimidos. De las numerosas especies de Pseudomonas
descritas sólo unas pocas tienen importancia en patología humana. Pseudomonas
mallei y P.pseudomallei causan enfermedad severa en el hombre pero se aíslan
raramente en el Hemisferio Occidental. Por otra parte P. cepacia es un
oportunista poco frecuentemente asociado con enfermedad en el hombre. Nos
referiremos en particular a la especie Pseudomona aeruginosa por su frecuencia
en patología humana y estar mejor estudiada que otros.

Es un microorganismo versátil, ampliamente distribuido en el suelo, agua, plantas e intestino de animales. Puede causar enfermedad en el hombre, ciertos animales, plantas e insectos. El agua contaminada puede ser una fuente de infección para el hombre. Es susceptible a la desecación, pero sus habilidades metabólicas le permiten sobrevivir y multiplicarse en líquidos y ambientes húmedos de los hospitales. Sus requerimientos nutricionales son variados, se ha aislado P. aeruginosa de aguas termales, e incluso de soluciones desinfectantes en el hospital. Las infecciones humanas están la mayoría restringidas a los pacientes hospitalizados que adquieren el microorganismo de fuentes ambientales (infección exógena) por contacto con vectores humanos o inanimados. P. aeruginosa desarrolla bien en medios simples, utilizándose para su aislamiento los medios de cultivo de uso corriente en el laboratorio clínico.
La identificación de cepas de P. aeruginosa típicamente productoras de pigmento no es difícil, pero las cepas no pigmentadas pueden presentar un problema. La mayoría se identifican por la producción de un pigmento, pyocyanina (Bacilo piociánico), soluble en agua, azul, no fluorescente. P. aeruginosa produce además otro pigmento, pyoverdina, soluble en agua, verdeamarillento, fluorescente; otras especies del género Pseudomonas también producen pyoverdina. Otros pigmentos, menos frecuentes pueden ser producidos por P. aeruginosa. La morfología colonial y el olor frutado de aminoacetofenona son elementos de una identificación sencilla, y aunque existen caracteres de identificación confirmatorios, son de uso poco corriente. Son bacilos Gram negativos, rectos o ligeramente curvos, móviles, con un solo flagelo polar. Oxidasa y catalasa positivas, aerobias estrictas, no fermentan glucosa, utilizan diversos azúcares oxidativamente con producción de ácido. Uno de los caracteres más constantes es su capacidad de desarrollar a 42ºC. Producen varias enzimas, proteasas, lipasas, lecitinasas.

Las defensas inespecíficas del huésped son en general suficientes para prevenir la infección por P. aeruginosa, pero brechas en esta barrera permiten a P. aeruginosa invadir y causar infecciones de diversa gravedad. Producen el 10% de las infecciones nosocomiales, infectan heridas y quemaduras y causan infecciones pulmonares, sobre todo neumonía nosocomial e infecciones respiratorias en pacientes con fibrosis quística. La fibrosis quística es una enfermedad genética asociada a un defecto en la secreción de cloro, caracterizada por la producción de mucina con una alteración de su composición iónica, inusualmente espesa. Esto lleva a una menor eficiencia de la mucina para limpiar las bacterias del pulmón y las vías aéreas y puede impedir el movimiento de las células fagocíticas. Estos hechos explican la susceptibilidad de los pacientes con fibrosis quística a la colonización con P. aeruginosa. Si los enfermos son tratados los síntomas pueden desaparecer pero las bacterias permanecen, presentando infecciones recurrentes. Las condiciones del paciente se ven agravadas con la infección a P. aeruginosa por las dificultades terapéuticas que se plantean debido a su alta resistencia a los antimicrobianos.
P. aeruginosa posee los mismos tipos de factores de virulencia que otras bacterias capaces de causar enfermedad en el hombre inmunocompetente. Pero algo interesante es ¿por qué P. aeruginosa no es un patógeno franco y es sólo capaz de producir infecciones oportunistas? Es probable que P. aeruginosa sea ineficiente en su habilidad para llevar a cabo los primeros pasos de la infección; puede colonizar pero no invadir piel y mucosas sanas y tampoco dar infecciones persistentes con producción concomitante de factores tóxicos que dañen los tejidos del huésped. Adhesinas. Produce dos tipos de adhesinas proteicas, pili y adhesinas no pili. Los pili son pili tipo 4 similares a los de N. gonorrhoeae y se parecen también a los pili Tcp de V. cholerae. Permiten a la bacteria adherirse a las células epiteliales, preferentemente a receptores asialo-GM1. P. aeruginosa produce una neuraminidasa que saca los residuos de ácido siálico de GM1, creando sitios de unión para la pilina.

Por otra parte, P. aeruginosa es capaz de unirse a la mucina y lo hace por medio de las adhesinas no pili. Además del gen que codifica para la proteína estructural del pili otros genes codifican proteínas ensambladoras y reguladoras. Exoenzima S. Es una enzima excretada que puede actuar como exotoxina. Tiene actividad de ADPribosilación como otras toxinas, pero aplicada en forma exógena no daña las células del huésped. Al igual que la toxina colérica intervienen proteínas de las células del huésped en la activación de la toxina para lograr su máxima actividad. Se sostiene que actuaría dificultando la acción de los fagocitos lo que facilitaría la sobrevida de P. aeruginosa en el torrente sanguíneo y órganos. En el pulmón actuaría inhibiendo la muerte intrafagocítica de las bacterias y promoviendo la infiltración fagocítica en el área. También puede presentar efecto tóxico directo en los pulmones.

Es un microorganismo versátil, ampliamente distribuido en el suelo, agua, plantas e intestino de animales. Puede causar enfermedad en el hombre, ciertos animales, plantas e insectos. El agua contaminada puede ser una fuente de infección para el hombre. Es susceptible a la desecación, pero sus habilidades metabólicas le permiten sobrevivir y multiplicarse en líquidos y ambientes húmedos de los hospitales. Sus requerimientos nutricionales son variados, se ha aislado P. aeruginosa de aguas termales, e incluso de soluciones desinfectantes en el hospital. Las infecciones humanas están la mayoría restringidas a los pacientes hospitalizados que adquieren el microorganismo de fuentes ambientales (infección exógena) por contacto con vectores humanos o inanimados. P. aeruginosa desarrolla bien en medios simples, utilizándose para su aislamiento los medios de cultivo de uso corriente en el laboratorio clínico.
La identificación de cepas de P. aeruginosa típicamente productoras de pigmento no es difícil, pero las cepas no pigmentadas pueden presentar un problema. La mayoría se identifican por la producción de un pigmento, pyocyanina (Bacilo piociánico), soluble en agua, azul, no fluorescente. P. aeruginosa produce además otro pigmento, pyoverdina, soluble en agua, verdeamarillento, fluorescente; otras especies del género Pseudomonas también producen pyoverdina. Otros pigmentos, menos frecuentes pueden ser producidos por P. aeruginosa. La morfología colonial y el olor frutado de aminoacetofenona son elementos de una identificación sencilla, y aunque existen caracteres de identificación confirmatorios, son de uso poco corriente. Son bacilos Gram negativos, rectos o ligeramente curvos, móviles, con un solo flagelo polar. Oxidasa y catalasa positivas, aerobias estrictas, no fermentan glucosa, utilizan diversos azúcares oxidativamente con producción de ácido. Uno de los caracteres más constantes es su capacidad de desarrollar a 42ºC. Producen varias enzimas, proteasas, lipasas, lecitinasas.
Las defensas inespecíficas del huésped son en general suficientes para prevenir la infección por P. aeruginosa, pero brechas en esta barrera permiten a P. aeruginosa invadir y causar infecciones de diversa gravedad. Producen el 10% de las infecciones nosocomiales, infectan heridas y quemaduras y causan infecciones pulmonares, sobre todo neumonía nosocomial e infecciones respiratorias en pacientes con fibrosis quística. La fibrosis quística es una enfermedad genética asociada a un defecto en la secreción de cloro, caracterizada por la producción de mucina con una alteración de su composición iónica, inusualmente espesa. Esto lleva a una menor eficiencia de la mucina para limpiar las bacterias del pulmón y las vías aéreas y puede impedir el movimiento de las células fagocíticas. Estos hechos explican la susceptibilidad de los pacientes con fibrosis quística a la colonización con P. aeruginosa. Si los enfermos son tratados los síntomas pueden desaparecer pero las bacterias permanecen, presentando infecciones recurrentes. Las condiciones del paciente se ven agravadas con la infección a P. aeruginosa por las dificultades terapéuticas que se plantean debido a su alta resistencia a los antimicrobianos.

P. aeruginosa posee los mismos tipos de factores de virulencia que otras bacterias capaces de causar enfermedad en el hombre inmunocompetente. Pero algo interesante es ¿por qué P. aeruginosa no es un patógeno franco y es sólo capaz de producir infecciones oportunistas? Es probable que P. aeruginosa sea ineficiente en su habilidad para llevar a cabo los primeros pasos de la infección; puede colonizar pero no invadir piel y mucosas sanas y tampoco dar infecciones persistentes con producción concomitante de factores tóxicos que dañen los tejidos del huésped. Adhesinas. Produce dos tipos de adhesinas proteicas, pili y adhesinas no pili. Los pili son pili tipo 4 similares a los de N. gonorrhoeae y se parecen también a los pili Tcp de V. cholerae. Permiten a la bacteria adherirse a las células epiteliales, preferentemente a receptores asialo-GM1. P. aeruginosa produce una neuraminidasa que saca los residuos de ácido siálico de GM1, creando sitios de unión para la pilina.
Por otra parte, P. aeruginosa es capaz de unirse a la mucina y lo hace por medio de las adhesinas no pili. Además del gen que codifica para la proteína estructural del pili otros genes codifican proteínas ensambladoras y reguladoras. Exoenzima S. Es una enzima excretada que puede actuar como exotoxina. Tiene actividad de ADPribosilación como otras toxinas, pero aplicada en forma exógena no daña las células del huésped. Al igual que la toxina colérica intervienen proteínas de las células del huésped en la activación de la toxina para lograr su máxima actividad. Se sostiene que actuaría dificultando la acción de los fagocitos lo que facilitaría la sobrevida de P. aeruginosa en el torrente sanguíneo y órganos. En el pulmón actuaría inhibiendo la muerte intrafagocítica de las bacterias y promoviendo la infiltración fagocítica en el área. También puede presentar efecto tóxico directo en los pulmones.
Exotoxina
A. Esta exotoxina tiene el mismo mecanismo que la toxina diftérica. Es una
toxina A-B con tres unidades funcionales:
-
dominio R (región de unión al receptor celular),
-
dominio T (región que media la translocación de la porción enzimática al
interior de la célula),- dominio C (región catalítica).
Los
dominios R y T se localizan en la cadena B y el dominio C en la cadena A. La
cadena A es enzimáticamente activa por ADPribosilación del factor de elongación
2 (EF-2) de la síntesis proteica, que lo vuelve inactivo. Su receptor es una
glicoproteína de las células del hospedero. La mayoría de los aislamientos
clínicos la producen, y actuaría produciendo daño en los tejidos y disminuyendo
la actividad de los fagocitos. Elastasas. Elastina es el 30% de las
proteínas del tejido pulmonar. Está también presente en la pared de los vasos
sanguíneos. Es responsable de las propiedades elásticas de estos órganos que se
expanden y contraen. P. aeruginosa tiene actividad elastolítica, produce dos
enzimas que actuarían concertadamente: LasA y LasB. LasA actuaría clivando la
elastina y permitiendo la acción de LasB, que es una zinc metaloproteasa, uno
de cuyos sustratos es la elastina.

Estas enzimas actuarían en las etapas tempranas de la enfermedad, por daño directo de los tejidos pero no en infecciones crónicas, debido a la presencia de anticuerpos antielastasas. También pueden intervenir degradando componentes del complemento e inhibidores de 1 proteinasa (inhibe el daño de los tejidos por las proteasas de los polimorfonucleares (PMNs)). En las infecciones crónicas, altos niveles de anticuerpos producidos pueden llevar a la formación de complejos inmunes y su depósito en el pulmón activar complemento y atraer PMNs. Los PMNs producen su propia elastasa, más potente que LasA-LasB. Pequeñas cantidades de LasA pueden facilitar la degradación de la elastina pulmonar causada por la elastasa de los PMNs. Otras enzimas extracelulares. Produce varias enzimas además de las mencionadas. Una lipasa alcalina y dos fosfolipasas, no bien estudiadas. Por otra parte, pyocianina puede funcionar como factor de virulencia. Puede dañar el tejido endotelial in vitro, lo que sugiere una acción in vivo. Un atributo de virulencia muy interesante es la producción de alginato. Es un polímero de ácido mannurónico y gulurónico que forma un gel viscoso alrededor de la bacteria. Las colonias que lo producen tienen aspecto mucoide. Para las bacterias marinas esto es un atributo importante para su supervivencia. P. aeruginosa ha adaptado esto a su supervivencia en el pulmón. En medios de cultivo ricos pierde esta propiedad. Esta capa que rodea a la bacteria y a las colonias de bacterias en el pulmón puede actuar como adhesina y probablemente previene la ingestión fagocítica de la bacteria. Los genes que intervienen en su codificación están agrupados en un sector del cromosoma y organizados en un operón, poseen un sistema de regulación extremadamente complejo. El LPS también varía durante la transición mucoide – no mucoide. En cepas no mucoides el antígeno O del LPS tiene cadenas largas y carga negativa mientras que las cepas mucoides tienen cadenas más cortas y una composición de azúcares que lo hacen mucho más neutro; esto sería importante en la alta resistencia a algunos antibióticos que presenta P. aeruginosa, situación problemática en pacientes internados, pero dramática en los pacientes con fibrosis quística, que muchas veces presentan infecciones por P. aeruginosa resistente a todos los antibióticos disponibles.
Estas enzimas actuarían en las etapas tempranas de la enfermedad, por daño directo de los tejidos pero no en infecciones crónicas, debido a la presencia de anticuerpos antielastasas. También pueden intervenir degradando componentes del complemento e inhibidores de 1 proteinasa (inhibe el daño de los tejidos por las proteasas de los polimorfonucleares (PMNs)). En las infecciones crónicas, altos niveles de anticuerpos producidos pueden llevar a la formación de complejos inmunes y su depósito en el pulmón activar complemento y atraer PMNs. Los PMNs producen su propia elastasa, más potente que LasA-LasB. Pequeñas cantidades de LasA pueden facilitar la degradación de la elastina pulmonar causada por la elastasa de los PMNs. Otras enzimas extracelulares. Produce varias enzimas además de las mencionadas. Una lipasa alcalina y dos fosfolipasas, no bien estudiadas. Por otra parte, pyocianina puede funcionar como factor de virulencia. Puede dañar el tejido endotelial in vitro, lo que sugiere una acción in vivo. Un atributo de virulencia muy interesante es la producción de alginato. Es un polímero de ácido mannurónico y gulurónico que forma un gel viscoso alrededor de la bacteria. Las colonias que lo producen tienen aspecto mucoide. Para las bacterias marinas esto es un atributo importante para su supervivencia. P. aeruginosa ha adaptado esto a su supervivencia en el pulmón. En medios de cultivo ricos pierde esta propiedad. Esta capa que rodea a la bacteria y a las colonias de bacterias en el pulmón puede actuar como adhesina y probablemente previene la ingestión fagocítica de la bacteria. Los genes que intervienen en su codificación están agrupados en un sector del cromosoma y organizados en un operón, poseen un sistema de regulación extremadamente complejo. El LPS también varía durante la transición mucoide – no mucoide. En cepas no mucoides el antígeno O del LPS tiene cadenas largas y carga negativa mientras que las cepas mucoides tienen cadenas más cortas y una composición de azúcares que lo hacen mucho más neutro; esto sería importante en la alta resistencia a algunos antibióticos que presenta P. aeruginosa, situación problemática en pacientes internados, pero dramática en los pacientes con fibrosis quística, que muchas veces presentan infecciones por P. aeruginosa resistente a todos los antibióticos disponibles.

Género
Hafnia
A éste
último grupo de enterobacterias me gusta llamarlas "las figuritas
difíciles del álbum" pues son raras de encontrar y de aislar. Hafnia
alvei es un bacilo gram negativo, única especie del género Hafnia, de la
familia Enterobacteriaceae, y que durante mucho tiempo fue incluida en el
género Enterobacter, hasta el desarrollo de las técnicas de biología molecular,
que determinaron su separación, con definición de un nuevo género. Se encuentra
ampliamente disperso en la naturaleza, en lugares como aguas residuales, suelo,
oro – faringe humana, intestino delgado y heces de personas y animales siendo
habitualmente un microorganismo colonizador. Se trata de un microorganismo
facultativo, usualmente no patógeno, que se ha aislado de cultivos orgánicos (faringe,
bronquio, sangre, orina y heces), produciendo infecciones en la gran mayoría de
los casos, en pacientes con enfermedad crónica de base, inmunodeprimidos y en
relación con estancias hospitalarias y utilización de antibioticoterapia de
amplio espectro. En los casos descriptos en la literatura el aislamiento de
Hafnia alvei se asocia a flora polimicrobiana, siendo difícil establecer su
implicación como agente causal. En la bibliografía revisada (MEDLINE de los
últimos 10 años) se han descrito casos de gastroenteritis, enterocolitis
necrotizante, colecistitis piógena, peritonitis, meningitis, infecciones del
tracto urinario, abscesos cutáneos, endoftalmitis, bacteriemias, endocarditis,
neumonía, empiema e infecciones de heridas en enfermos hospitalizados. H.
alvei es un bacilo cuyo nombre es enterobacter hafniae y puede ser responsable
de infecciones graves adquiridas en la comunidad o en el hospital,
constituyendo Enterobacter y Hafnia, agentes de infección nosocomial en el 5%
de los casos. En adultos se considera una causa excepcional de bacteremia,
neumonía, infección nosocomial de tejidos blandos, colonización de catéteres
centrales, infección postransplante, endocarditis protésica, septicemia con
shock y coagulación intravascular diseminada. Esto es así porque los
sujetos con infección por H. alvei, excepto aquéllos con afectación intestinal,
suelen tener una enfermedad grave de base, enfermedad pulmonar obstructiva
crónica, diabetes mellitus, insuficiencia renal crónica, cáncer o una serología
VIH positiva.

Género
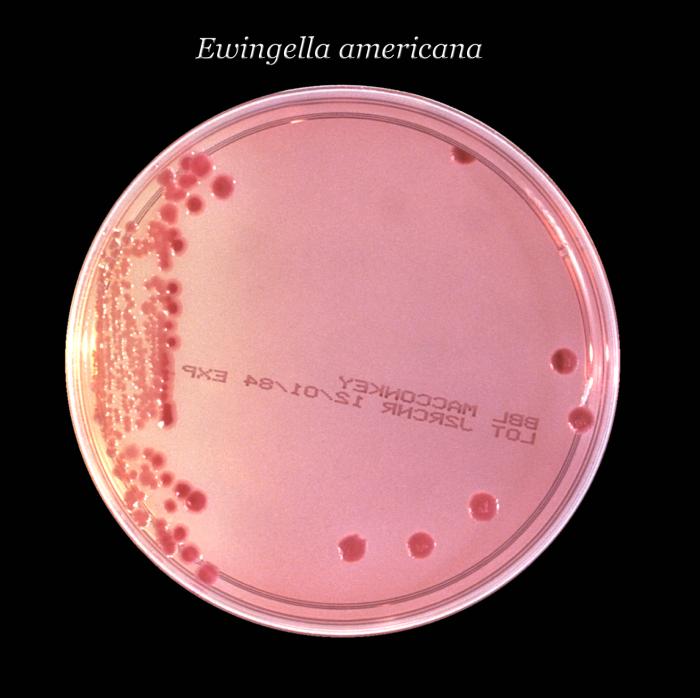
Ewingella
Ewingella, previamente
conocido como Grupo Entérico 40, es un nuevo género en la familia de
Enterobacteriaceae y se describió primero por Grimont y colaboradores en
1983. Este género incluye sólo una especie, la Ewingella americana.
Este microorganismo raramente se encuentra en las muestras clínicas humanas. La
fuente más común ha sido sangre, pero también se ha aislado del esputo,
orina y heridas. En
la mayoría de los casos, la importancia de la patogenia de este organismo,
aunque sugestivo, no se ha establecido. Recientemente, informes esparcidos de
infecciones debidas a E. americana han aparecido en la literatura. Ahora
es más frecuente observar su desarrollo en peritonitis causado por E. americana
en pacientes con fases finales de enfermedad renal que sufren la diálisis
peritoneal ambulante continua desde hace más de 12 años. La causa primaria de
fracaso renal era la enfermedad del riñón poliquístico.
Género
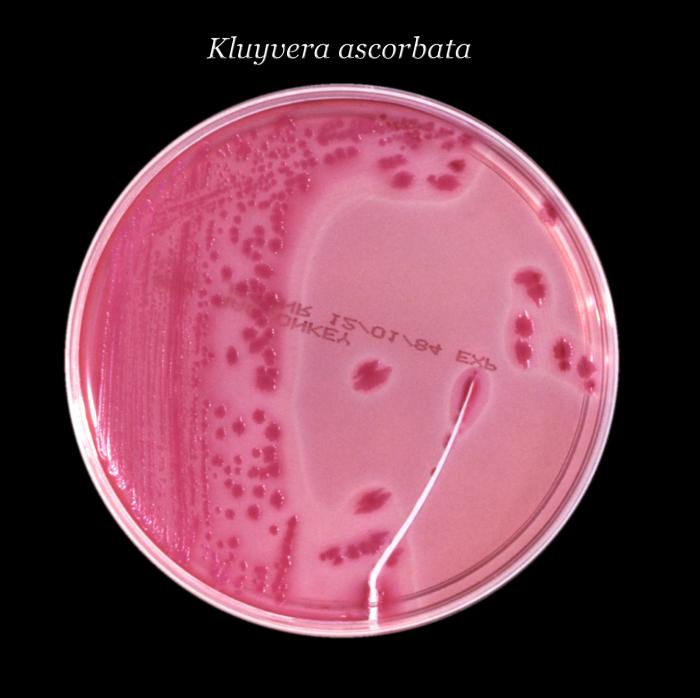
Kluyvera
Kluyvera corresponde
a un nuevo género llamado: Grupo Entérico 8. Se divide en tres grupos:
•
Kluyvera ascorbata, que sería la especie tipo y que se aísla preferentemente de
especímenes clínicos, es incapaz de crecer a 5º C, e in vitro es inhibida por cefalotina
y carbenicilina. Es test de ascorbato positivo a diferencia de la segunda
especie,
•
Kluyvera cryocrescens que es negativa ante este test y que se aísla más
del medio ambiente que del paciente.
•
Finalmente existe un grupo heterogéneo, sin nombre específico llamado Kluyvera
especie grupo tres, distinto genéticamente de los anteriores.
Las
cepas de Kluyvera tienen las mismas características de la familia
Enterobacteriaceae a la cual pertenecen, son bacilos Gram (-) con flagelos
perítricos lo que la hacen móviles, catalasa (+) y oxidasa (-), crecen en agar
de Macconkey, fermentan la glucosa y son indol (+), rojo metilo (+). Vogues
Proskauer (-), citrato (+), H2S (-), ureasa (-), fenilalanina
deaminasa (-) y arginina dihidrolasa (-), lisina (+) y ornitina descarboxilasa
(+). Es difícil diferenciarlas de Escherichia coli. Según resultados
a través del Microscan, pudimos apreciar que es una colonia más seca y rugosa y
con un fenotipo de mayor resistencia a antimicrobianos que E. coli. Todavía se requiere
mayor información para que podamos adjudicarle un significado clínico a este
género.
Género
Cedecea
Cedecea davisae
es un bacilo gramnegativo, que pertenece a la familia de las
Enterobacteriaceae; aunque tiene diferencias fenotípicas con los otros
microorganismos de esta familia de bacterias, tiene grandes similitudes
con la Serratia. Es lipasa positiva, siendo resistente a la acción
antimicrobiana de algunas cefalosporinas y de la colistina. Se han comunicado
aislamientos por este infrecuente microorganismo en esputo, tracto
gastrointestinal, heridas de las manos, escroto y ojos y también se ha aislado
en algunos casos de bacteriemias. No se ha encontrado a la fecha ningún
caso de absceso de puerta de entrada de laparoscopia en el que se haya aislado
este microorganismo, pero no es de extrañar que sea un oportunista en éste tipo
de técnicas quirúrgicas. El nombre de Cedecea fue propuesto recientemente para un único
nuevo género en el ancho mundo de las Enterobacteriaceae, previamente conocido
como Grupo Entérico 15. Los extendidos de Cedecea se parecen a los de Serratia
porque ellos son lipasas positivas y resistentes al cephalothin y
colistin. Sin embargo, Serratia difiere de Cedecea al no hidrolizar la
gelatina y el ADN. Dos especies se nombraron originalmente en Cedecea: C.
davisae y C. lapagei, pero la hibridación de ADN indicó que otro grupo era
distinto y debe ser considerado entonces como un tercero adicional.
Género
Moellerella
El
nombre de Moellerella wisconsensis se propone previamente para un grupo de la
familia Enterobacteriaceae llamado los Grupos Entéricos 46. La especie
wisconsensis se acuñó porque se aislaron seis de las nueve especies reconocidas
en Wisconsin (USA). Estas especies de wisconsensis eran negativas para: la
producción del indol, Voges – Proskauer, producción de SH2, urea,
deaminasa de la felilalanina, lisina y decarboxilasa de la ornitina,
dihidrolasa de la arginina, la producción de gas de la D – glucosa,
la producción ácida de la trealosa y la motilidad. En cambio, eran positivas para: el
rojo de metilo, citrato (Simmons), producción ácida de la lactosa y rafinosa y
resistente al colistin. La información clínica sobre un caso de un paciente
internado encontrado en USA puede a priori ser asociado con un caso de diarrea
del mismo no por su patogenicidad sino por su oportunismo. En el agar de MacConkey, las
colonias de M. wisconsensis eran luminosas y rojas con la bilis precipitada
alrededor de ellos y así eran indistinguible de las colonias de Escherichia
coli. Los estudios futuros deben enfocar en el aislamiento de este nuevo
organismo y su relación a la enfermedad humana, por sobre todo a la trasmisión
por los alimentos (ETA).
Género
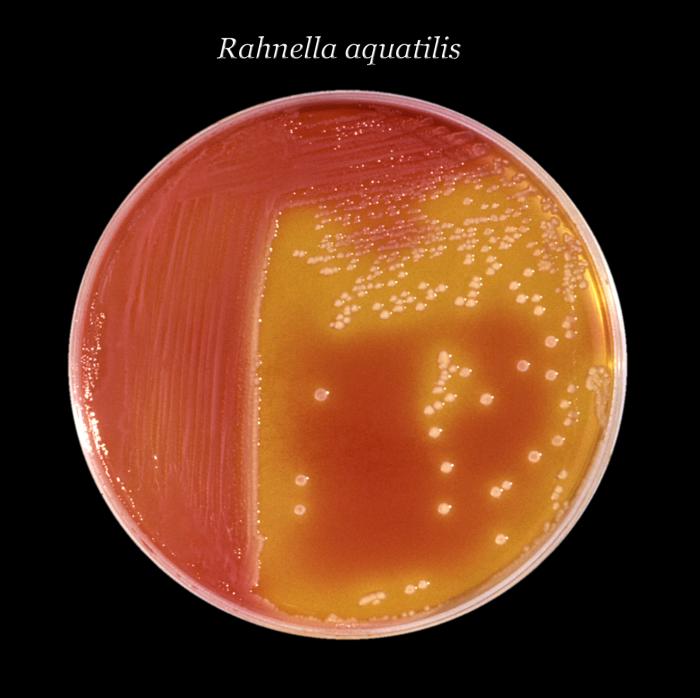
Rahnella
Entre
los cambios que ha experimentado el trabajo con bacterias y hongos tenemos los
adelantos en la identificación, que ha pasa o rápidamente manual a
automatizada, lo que ha permitido crear una serie de bases de datos con las
cuales se aumentan las posibilidades de identificación correcta de un
organismo. La primera de esas bases de datos es la utilizada por
el sistema API de la Casa BioMerieux, la cual ha mejorado e introducido
una serie de nuevos organismos. Esta misma base de datos se utiliza en los
sistemas automatizados como el Vitek de la misma casa comercial y otras bases
de datos de características similares se emplean en sistemas como el MicroScan
de la Casa Dade. Unido
a esta mejoría en la identificación de los microorganismos y como un paso más
adelante, está el hecho de que el futuro en la clasificación de los
microorganismos parece dirigirse al uso de los métodos moleculares, ya sea PCR
o hibridización. Este futuro ya casi está entre nosotros y técnicas
como el ribotipeo o técnicas para la detección de genes de resistencia
bacterianos ya son de uso en algunos laboratorios de investigación.
Todo esto ha permitido ampliar la
gama de organismos que los laboratorios clínicos pueden identificar, entre
ellos los de muy baja frecuencia de aislamiento a nivel mundial, como es el
caso de la Rahnella aquatilis que es un raro bacilo Gram negativo que
pertenece a la familia Enterobacteriaceae y fue aislado por primera vez
en 1979. Ha sido aislado
principalmente de agua fresca y los aislamientos clínicos son sumamente
escasos. Ha sido encontrado en el catéter de un paciente con bacteremia
posterior a un transplante de médula ósea, en orinas de pacientes que han
recibido un transplante renal, en heridas quirúrgicas infectadas, en sangre, en
muestras respiratorias y en heces. Algunos de estos pacientes estaban
infectados con el virus de la inmunodeficiencia adquirida. Es importante
mencionar que dada la rareza de los aislamientos de Rahnella aquatilis en
muestras humanas, no es posible establecer, con algún grado de certeza, su
verdadera capacidad patogénica.
"SOMOS LO QUE HACEMOS REPETIDAMENTE. EXCELENCIA, POR LO TANTO, NO ES UN ACTO SINO UN HÁBITO"
ARISTOTELES
LEGALES: El autor no asume responsabilidad alguna por la descarga, copia, distribución, modificación o alteración de los contenidos publicados, sean propios del mismo o de terceros, los cuales pudieren estar protegidos por Copyright, Derechos de Propiedad Intelectual, Derechos de Autor, o relacionados. La Bibliografía del tema expuesto y el crédito fotográfico está en poder del Autor y no se publica dada su extensión, pero se enviará por mail al interesado que la solicitare debidamente fundamentada.


Comentarios
Publicar un comentario