Las Enfermedades transmitidas por los alimentos (Parte 6)
Más de una vez Ud. habrá dicho: “Debe ser algo que comí”,
“Algo me cayó mal” ó “Me dio un ataque de hígado”, luego de haber estado con
diarreas, vómitos, dolor de cabeza ó cólicos. Lo más probable es que sí; algo
le cayó mal, y no precisamente lo que comió, sino, lo que no vio al ingerir ese
alimento, ya que éste tenía el aspecto de estar sano, pero...no fue así.- Lo
que usted sufrió fue una Enfermedad Transmitida por los Alimentos (ETA)
LAS ENFERMEDADES TRANSMITIDAS POR LOS ALIMENTOS (Parte 6)
GÉNERO
PROTOZOOS
El
reino Protista y el subreino Protozoa, agrupan los organismos unicelulares que
siempre hemos denominado protozoos o protozoarios, unos de vida libre y otros
parásitos de animales y plantas. Son microscópicos y se localizan en diferentes
tejidos. Algunos son inofensivos, otros producen daños importantes que
trastornan las funciones vitales con producción de enfermedad y en ciertos
casos la muerte del huésped. La mayoría de los protozoos son móviles en una
etapa de su desarrollo, lo que se conoce con el nombre de forma vegetativa o
trofozoito. Algunos de éstos tienen la capacidad de transformarse en una forma
de resistencia, conocida como quiste. Los trofozoítos constan de membrana,
citoplasma y núcleo. La membrana varía de espesor según las especies y sus principales
funciones son: limitar el parásito, servir como elemento protector y permitir
el intercambio de sustancias alimenticias y de excreción. El citoplasma es una
masa coloidal y representa el cuerpo del organismo, en algunas especies se
puede diferenciar claramente una parte interna, granulosa y vacuolada llamada
endoplasma y otra externa, hialina, refringente que es el ectoplasma. En
algunos protozoos existen vacuolas en el citoplasma, unas son alimenticias
encargadas del metabolismo de los nutrientes y otras excretoras que facilitan
la eliminación de sustancias. También se encuentran mitocondrias y sustancias
nutritivas de reserva que reciben el nombre de cuerpos cromatoidales.
El
núcleo es esférico u ovoide, se encuentra localizado en cualquier parte del
citoplasma. En general consta de membrana, gránulos de cromatina y
cariosoma o nucléolo, casi siempre es único y sus funciones principales son las
de regular la síntesis proteica y la reproducción. En los seres unicelulares
existen ciertas partes de la célula llamadas organelas, que se especializan en
llevar a cabo funciones vitales como alimentación, respiración, reproducción y
locomoción. La alimentación se realiza mediante diferentes
mecanismos. El más simple es la osmosis, que consiste en el intercambio de
sustancias orgánicas disueltas en el medio donde viven, a través de su
membrana. Otro procedimiento es la fagocitosis, que se realiza por medio de
prolongaciones de su ectoplasma o seudópodos, las cuales engloban las
partículas alimenticias hasta incorporarlas al citoplasma. Un tercer mecanismo
se observa en ciertos protozoos que utilizan sus cilias o flagelos para acercar
los nutrientes a una boca o citostoma por donde penetran a la célula. El metabolismo se lleva a cabo en
las vacuolas donde se producen enzimas digestivas. Los residuos de este
metabolismo se eliminan a través de la membrana celular, en algunas especies se
hace por un orificio excretor llamado citopigio, en otras sólo se liberan los
residuos cuando sucede la ruptura de la célula, como es el caso de la
liberación del pigmento malárico, en los protozoos del género Plasmodium.
La respiración en algunos protozoos es aerobia y en otros anaerobia. En la
primera toman el oxígeno de su medio ambiente y expulsan el dióxido de carbono
a través de la membrana celular. En la segunda necesitan metabolizar ciertas
sustancias de las cuales obtienen el oxígeno. Los protozoarios se
multiplican por reproducción asexual y sólo algunos tienen reproducción sexual.
La asexual tiene dos modalidades: a) División binaria. Consiste en la división
longitudinal o transversal de las formas vegetativas, de la cual resultan dos
nuevos seres iguales al primero. Este tipo de división puede ser
mitótica o amitosis. b) División múltiple. Ocurre cuando una célula da
origen a varias formas vegetativas. Se llama esquizogonia cuando el núcleo del
trofozoito se divide varias veces para dar origen a una célula
multinucleada; posteriormente cada nuevo núcleo se rodea de una porción del
citoplasma de la, célula madre y luego se separa en organismos
independientes. En
algunos protozoos existe una reproducción similar pero a partir de quistes
multinucleados. El número de nuevos organismos que se originan en la
reproducción múltiple depende de cada especie. La reproducción
sexual existe en ciertos protozoos como Plasmodium. Las formas trofozoíticas no
dividen su núcleo, sino que sufren una serie de diferenciaciones morfológicas,
transformándose en células masculinas o femeninas llamadas gametocitos, que
maduran sexualmente y constituyen los gametos, los cuales se unen y forman el
cigoto que da origen a numerosos organismos.
Existe otro tipo de reproducción
sexual menos frecuente en los protozoos del hombre, denominada conjugación,
como ocurre en Balantidium consistente en la unión de dos células, entre las
cuales se forma un puente citoplasmático por donde intercambian material
genético, después de lo cual se separan y cada una sigue su proceso de división
binaria. Los protozoos presentan mecanismos diversos de locomoción, función que
se tiene en cuenta como uno de los parámetros para su clasificación. Un grupo
se moviliza por la formación de seudópodos que ejercen tracción sobre el
citoplasma. Por aparición sucesiva de éstos se produce el desplazamiento del
parásito. Los protozoos que se movilizan por este mecanismo se les clasifica en
la clase Rhizopodea. Otros
presentan varios filamentos móviles o flagelos que se mueven a manera de
látigo, produciendo desplazamiento de la célula y se agrupan en la clase
Zoomastigophorea. Los que tienen su cuerpo cubierto de cilias o pestañas
vibrátiles que se mueven sincrónicamente y producen la traslación del organismo,
se clasifican en el filum Ciliophora. Un grupo carece de órganos de locomoción
en casi todas sus etapas de desarrollo, como ocurre en la clase Sporozoea.

Amebiasis, Amibiosis o Amebosis (CIE-10 a06)
La infección por Entamoeba histolytica se estima que afecta al 10 % de
la población mundial con mayor impacto en los países tropicales. Es un parásito
unicelular con una forma vegetativa o trofozoíto (móvil, lábil, no infectante)
y quistes (forma de resistencia e infectante). Tiene distribución universal con
predominio en las regiones templadas, subtropicales y tropicales. Las áreas de
alta endemicidad en la sub región latinoamericana son América Central y el
norte de América del Sur. Es de reservorio humano exclusivo. El riesgo de
exposición es inversamente proporcional al nivel socioeconómico cultural. Entamoeba histolytica, especie
parásita del hombre, que puede vivir como comensal en el intestino grueso,
invadir la mucosa intestinal produciendo ulceraciones y tener localizaciones
extraintestinales. A pesar de que el término técnico para designar esta
parasitosis es entamoebosis, emplearemos, como excepción, el término amebiasis,
por su amplio uso. Koch en 1883, revisando autopsias en una epidemia de cólera,
demostró las amebas en la submucosa de la pared intestinal, en los capilares
cercanos a la pared de abscesos hepáticos y en el exudado de lesiones del
hígado.
Los hallazgos de Koch fueron confirmados totalmente por Kartulis
(1885-1887), al demostrar la presencia de amebas en 150 autopsias de casos de
disentería. A este autor se le considera el primero en afirmar que la ameba era
el agente etiológico de la disentería tropical y que el absceso del hígado era
una secuela de la disentería amebiana. Posteriormente se adoptó el nombre
genérico Entamoeba, que había sido propuesto desde el siglo pasado. Alrededor del 10 %
de los infectados (50-100 millones) presenta manifestaciones clínicas y de
éstos la décima parte cursa con localización extraintestinal. La enfermedad es
infrecuente en menores de 5 años y especialmente en menores de 2 años. La forma
invasora afecta más a los adultos jóvenes y los abscesos hepáticos tienen mayor
frecuencia en el género masculino. La amibiasis fulminante puede observarse en
menores de 2 años, gestantes, desnutridos graves e inmucocomprometidos. Es
causa de aproximadamente 100.000 muertes/año. Un estudio seroepidemiológico de
prevalencia por técnica IHA realizado en México demostró un 8,4 % de
positividad con el pico (11 %) en el grupo de 5-9 años. Los quistes se eliminan
durante períodos variables por las heces. El agua y los alimentos constituyen
el principal mecanismo de transmisión. Los quistes que se ingieren con el agua
o alimentos contaminados son estimulados por el ácido clorhídrico del estómago
y liberan en el intestino delgado los trofozoítos. La multiplicación es
por fisión binaria en el intestino delgado y alcanzan el colon donde se
adhieren y destruyen a las células epiteliales, hematíes, linfocitos y
monocitos. Producen ulceraciones en la mucosa, viven como comensales y pueden
alcanzar la circulación lo que resulta en las localizaciones extraintestinales.
En la luz del intestino los trofozoítos eliminan las vacuolas alimenticias y
demás inclusiones intracitoplasmáticas, se inmovilizan y forman prequistes;
éstos adquieren una cubierta y dan origen a quistes inmaduros con un núcleo,
los cuales continúan su desarrollo hasta los típicos quistes tetranucleados. La
formación de quistes sucede exclusivamente en la luz del colon y nunca en el
medio ambiente o en los tejidos. En las materias fecales humanas se pueden
encontrar trofozoítos, prequistes y quistes; sin embargo, los dos primeros
mueren por acción de los agentes físicos externos y en caso de ser ingeridos
son destruidos por el jugo gástrico; solamente el quiste es infectante por vía
oral. En el medio externo los quistes permanecen viables en condiciones
apropiadas durante semanas o meses y son diseminados por agua, manos,
artrópodos, alimentos y objetos contaminados. Finalmente los quistes llegan a
la boca para iniciar la infección; una vez ingeridos sufren la acción de los
jugos digestivos, los cuales debilitan su pared y en el intestino delgado se
rompen y dan origen a trofozoítos, que conservan el mismo número de núcleos de
los quistes; en posterior evolución cada núcleo se divide en dos y resulta un
segundo trofozoíto metacíclico, con 8 núcleos.
En la luz del colon cada núcleo
se rodea de una porción de citoplasma y resultan 8 trofozoítos pequeños que
crecen y se multiplican por división binaria. El período prepatente varía entre
48 horas y 4 meses. El período de incubación oscila de 7 a 10 días. El
período de estado varía desde la infección asintomática a la enfermedad
invasiva de localización intestinal: disentería, apendicitis, colitis,
megacolon tóxico, perforación con peritonitis, colitis no disentérica crónica,
amebotas, y con localización extraintestinal: abscesos hepático, pulmonar,
empiema pleural, absceso cerebral. La forma más frecuente de presentación que
es la disentería amibiana tiene un comienzo subagudo caracterizado por diarrea
mucosanguinolenta, dolor cólico abdominal, flatulencia, pujo y tenesmo, pérdida
de peso. La fiebre se observa en el 30 % de los casos. La diarrea se prolonga
por 1-4 semanas. Únicamente del 10 al 25% de las personas que presentan E.
histolytica en el colon son sintomáticas. El resto se consideran portadoras
sanas. No todos los que tengan la especie patógena presentan enfermedad, pues
ésta depende de la interacción entre la virulencia del parásito y las defensas
del hospedador. Se afirma que una disentería es amebiana cuando se
observan en el examen en fresco trofozoítos con hematíes en su interior. El
estudio de anticuerpos específicos IHA, ELISA, ID es útil en la enfermedad
extraintestinal cuando el parásito no se detecta en heces. los analisis en
alimentos y otras muestras llevarán a la investigación de quistes y
trofozoítos. El metronidazol es la droga de elección para el tratamiento de la
disentería amebiana y otras formas invasivas, en dosis de 500 mg cada 8 horas
en los adultos y de 35-50 mg/kg/día, fraccionado cada 6-8 horas en los niños,
durante 7-10 días. También puede utilizarse el tinidazol en dosis de 2 g/día en
los adultos y 50 mg/kg/día en los niños en una toma diaria durante 3-6 días.
Los nitroimidazólicos no son efectivos para tratar quistes, por lo tanto pueden
emplearse como complementarios el yodoquinol o el furoato de diloxanida o la
paramomicina que tienen acción intraluminal. Las medidas de prevención y
control, son pilares fundamentales:

- El saneamiento básico (provisión de agua segura y eliminación sanitaria de excretas)
- La educación para la salud (hábitos higiénicos, manejo higiénico de los alimentos).
- La cloración no destruye los quistes, el agua no potable debe alcanzar temperatura de ebullición durante un minuto. También pueden utilizarse para pequeñas cantidades, 8 gotas de tintura de yodo al 2 % ó 12, 5 ml de una solución saturada de cristales de yodo por litro de agua y dejar actuar durante 10 minutos o 30 minutos si el agua está fría, antes de su consumo.
- Tratamiento de los portadores identificados.
Criptosporidiosis (CIE-10 a07.2)
Es una enfermedad emergente. Los primeros casos fueron descritos en 1976
y desde mediados de la década del '80, han ocurrido epidemias transmitidas por
agua en distintas comunidades. Cryptosporidium parvum, coccidio del
subreino Protozoa es el causante. Se han identificado dos genotipos: el 1 (o
humano) exclusivamente del hombre y de los primates no humanos y el 2 en el
ganado y el hombre, lo que podría indicar que serían dos especies con ciclos
exclusivos de transmisión. La dosis infectante es baja (hasta un quiste) y en
promedio 132. Tiene distribución universal. La mayor ocurrencia se observa en
primavera lo cual estaría relacionado con el aumento de las precipitaciones y
la posibilidad de contaminación de las fuentes de agua. Ha sido encontrado en
el 87 % de las muestras de agua en los Estados Unidos y Canadá. La
infección se adquiere por vía oral y es de origen fecal. Puede proceder de
personas infectadas que contaminan a través de manos, contaminación oro-anal,
aguas, hortalizas, etc. La infección también puede transmitirse por materia
fecal de animales que sufran la parasitosis. Los animales reservorios son
muchos, por lo cual se considera una zoonosis frecuente. Los ooquistes son muy
resistentes a las condiciones del medio ambiente y pueden sobrevivir en el
suelo por varios meses.
Pueden resistir algunos desinfectantes comunes,
pero pierden su viabilidad con la congelación y la ebullición. Se considera la
quinta causa de diarrea en niños inmunocompetentes y la prevalencia en la
población infantil ha variado de 2% a 30% de acuerdo a los países y a las
condiciones higiénicas de las poblaciones estudiadas. En Colombia se ha
encontrado 4% de positividad en niños con diarrea en estudios basados en el
examen directo con coloración ácido-resistente, mientras que en México, donde
utilizaron inmunofluorescencia con anticuerpos monoclonales, encontraron
frecuencias de 9 a 30%. En población general se presentan ocasionalmente brotes
o epidemias, debidas a contaminación alimentaria y la incidencia tiene
variaciones estacionales o de acuerdo al clima, como se comprobó en Costa Rica,
en donde la frecuencia en niños con diarrea aumentó de 4% a 15% entre mayo y
agosto, la época caliente y lluviosa. Se considera una de las causas de la
diarrea de los viajeros. Con estudios seroepidemiológicos en la población, se
detectan anticuerpos y se han encontrado frecuencias de 25% a 35% en Estados
Unidos y de más de 50% en América Latina y en China. La relación
epidemiológica más importante es que se ha encontrado en portadores de VIH y en
pacientes con SIDA. En ambos casos el parásito se comporta como un agente
invasor oportunista. Se calcula que en países desarrollados los pacientes VIH
positivos son portadores del parásito entre 10% y 15% y en países en desarrollo
entre el 30% y el 50%.

En pacientes con SIDA en Colombia, el 45.3% de los que
tenían diarrea fueron positivos para Cryptosporidium en materia fecal y en
Venezuela el 41.3%. En contraste, sólo de 4% a 5% fueron positivos en casos
similares de Estados Unidos. En el año 2000 el número de personas infectadas
por VIH en el mundo era de 38 millones y han llegado casi a 40 millones a
finales de 2014. Estas cifras alarmantes, que aumentan permanentemente, hacen
necesario que se establezcan medidas de control para los agentes oportunistas
que ya son más de 100. En pacientes inmunocompetentes la diarrea
generalmente es autolimitada y no requiere tratamiento. El problema grave de la
diarrea se presenta en los inmunosuprimidos. El reservorio primario está
constituido por el ganado bovino y animales domésticos y el hombre. La
transmisión es por contaminación fecal del agua y los alimentos (vegetales,
frutas, leche no pasteurizada), también ocurre de persona a persona y de
animales al hombre. Los quistes eliminados son infectantes y se mantienen
durante 2-6 meses. Han sido comunicados numerosos brotes que afectaron
415.000 personas desde 1984. El más importante ocurrió en Milwaukee (Wisconsin,
Estados Unidos) con 403.000 personas con diarrea. La modificación del estándar
de turbidez del agua potable (Menos de 0,17 unidades nefelométricas), sin
embargo, no impidió el brote de Las Vegas.

Un siglo después de su
descubrimiento y después de casi tres décadas de intensas investigaciones,
Cryptosporidium sigue siendo, en muchos aspectos, un enigma. Perteneciente al
phylum Apicomplexa, posee como otros coccidios entéricos de vertebrados un
ciclo de vida monoxeno que se completa primariamente en el tracto
gastrointestinal de un solo huésped. Sin embargo, posee características únicas
que lo distinguen de otros coccidios. La localización peculiar dentro de la
célula huésped, intracelular pero extracitoplasmática, que confina los estadios
de desarrollo endógeno a la superficie apical de las células epiteliales; la
unión del parásito a la célula huésped a través de una organela multimembranosa
en la base de la vacuola parasitófora que facilita la incorporación de
nutrientes desde la célula huésped; la presencia de dos tipos morfofuncionales
de ooquistes, los de paredes gruesas que son excretados, y los de paredes
delgadas, responsables de la iniciación del ciclo autoinfectivo en el huésped
infectado; el tamaño pequeño de los ooquistes que carecen de estructuras
morfológicas tales como micrópilo, esporoquistes y gránulos polares y,
finalmente la insensibilidad a todos los agentes anticoccidiales probados. Los
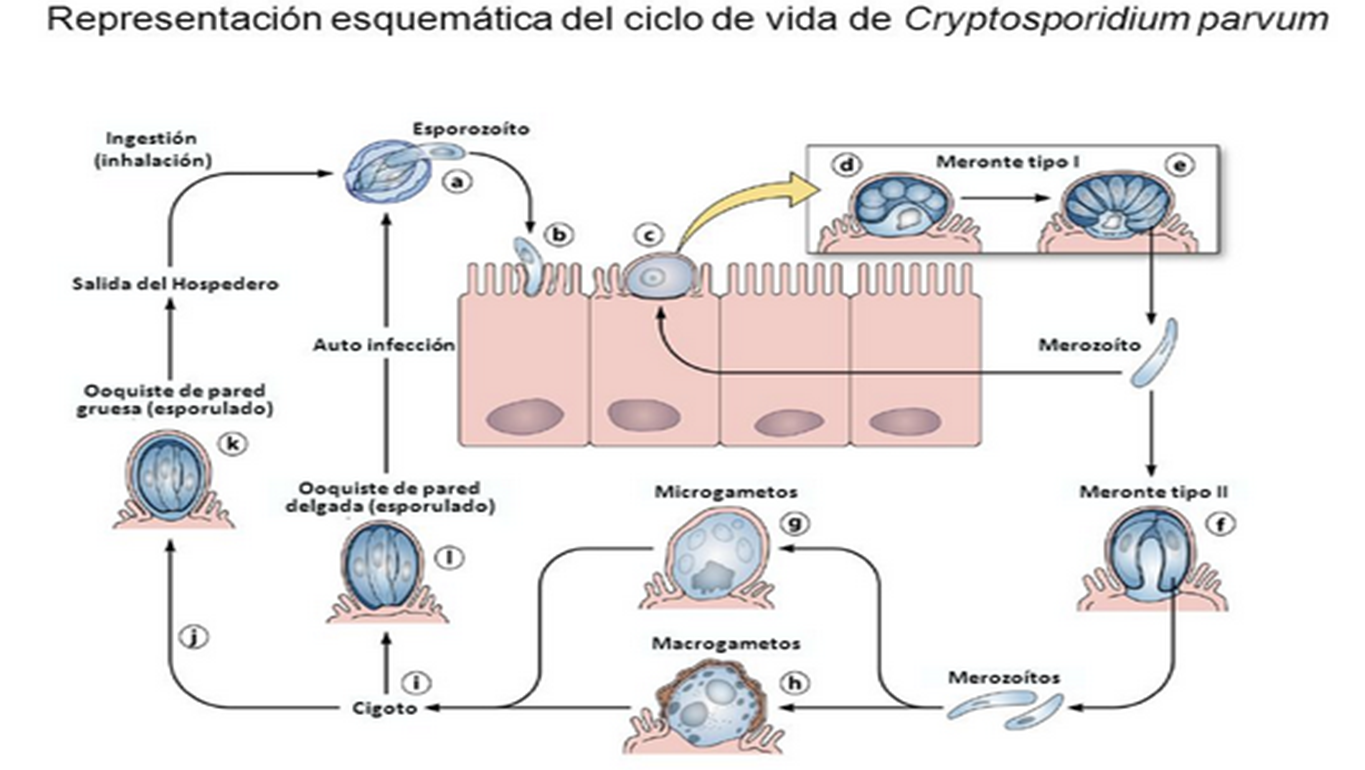
coccidios del género Cryptosporidium tienen un ciclo de vida monoxeno pues
todas las etapas de su desarrollo (sexual y asexual) se completan dentro del
tracto gastrointestinal de un único huésped.
Presentan un estadio exógeno
que corresponde a los ooquistes esporulados excretados por las heces de los
huéspedes infectados, u otros materiales biológicos como las secreciones
respiratorias. El diámetro de cada ooquiste varía entre 4 y 6 μm. La fase
endógena del ciclo comienza una vez que el huésped apropiado ingiere (o inhala)
los ooquistes que contienen cuatro estadios haploides o esporozoítos, los
cuales escapan a través de una fisura que se abre en la pared del ooquiste. Al
parecer las fluctuaciones de pH en el tracto gastrointestinal, las sales
biliares, las enzimas pancreáticas y la temperatura favorecen el
desenquistamiento, probablemente, a causa del aumento de la permeabilidad de la
pared del ooquiste, la movilidad de los esporozoítos dentro del ooquiste y la
consecuente exposición de receptores. El esporozoíto se adhiere a receptores de
la membrana apical de la célula epitelial del huésped mediante diversos
ligandos, GP900, P23, CP47, entre otros. Este proceso induce la reorganización
del citoesqueleto de actina y la protrusión de la membrana de la célula huésped
alrededor del esporozoíto para formar una vacuola parasitófora, donde el
microorganismo permanece en posición intracelular pero extracitoplasmática.
Dentro de la vacuola, el parásito, que en este estadio recibe el nombre de
trofozoíto, comienza un ciclo de multiplicación asexual (esquizogonia o
merogonia) y luego continúa con una multiplicación sexual (gametogonia).
Durante el ciclo de proliferación asexual se forman merontes de los cuales
emergen merozoítos capaces de infectar otras células del huésped, en las que
iniciarán otra merogonia o, alternativamente, una gametogonia para
diferenciarse en estadios sexuales llamados gamontes (gametocitos).
Durante
la gametogénesis, los gametocitos masculinos liberan varias microgametas,
mientras que los gametocitos femeninos se diferencian en una única macrogameta.
Luego de la fertilización el estadio diploide resultante (zigoto) sufre
meiosis, mecanismo que restaura el estado haploide. A partir de aquí se inicia
el proceso de esporogonia en el cual el zigoto sufre uno o más ciclos de
división mitótica para formar un ooquiste que contiene los esporozoítos
infectivos. Si bien se asume que la localización normal en un huésped
inmunocompetente es el tracto gastrointestinal, en individuos
inmunocomprometidos se han descripto fases extraintestinales en vías aéreas,
árbol biliar, hígado, vejiga y páncreas. Cryptosporidium es un patógeno
entérico que desencadena una enfermedad diarreica cuya morbilidad y mortalidad
son significativas tanto para los seres humanos como para los animales. El
desarrollo de nuevas técnicas moleculares ha permitido identificar a los
genotipos C. hominis y C. parvum como aquellos que con mayor prevalencia
infectan al hombre. Las rutas de transmisión son múltiples (persona a persona,
animales a personas, agua, alimentos, aire) y la enfermedad puede afectar a
individuos inmunocomprometidos o no. Es un microorganismo emergente cosmopolita
cuya aparición no está limitada a ninguna región geográfica o al grado de
desarrollo tecnológico de la misma. Los procesos de urbanización acelerados, la
expansión de la pobreza, las migraciones no controladas de gran número de
refugiados, la facilidad y rapidez en los desplazamientos, el movimiento
creciente de animales y de productos de origen animal, la falta de saneamiento
ambiental, son algunos de los factores que, sumados a la escasez de normas
legales regulatorias, han posibilitado la dispersión de la enfermedad. La
resistencia a los antibióticos incrementa las tasas de morbilidad y mortalidad
y los gastos de atención médica asociados con el control de brotes epidémicos.
La criptosporidiosis, entonces, representa una amenaza de alcance mundial que
exige una respuesta coordinada de los servicios de salud pública de todos los
países. Los quistes ingeridos se localizan en el tubo digestivo (desde la
faringe al recto) con mayor frecuencia en el intestino delgado (yeyuno). Se
ubican en el glicocálix del enterocito donde se desenquistan y cada uno elimina
cuatro esporozoítos que invaden las células epiteliales. Allí cumplen un ciclo
asexuado y otro sexuado que resulta en el ooquiste infectante eliminado a la
luz intestinal. El parásito en las microvellosidades determina la malabsorción
de nutrientes y la retención de agua en la luz intestinal lo que desencadena la
diarrea osmótica. Además es la causa del edema y la atrofia de las vellosidades
lo que resulta en una disminución de la superficie de absorción. Las heces
humanas son infectantes a partir de los 5 - 21 días de la infección. El período
de incubación es de 1 a 21 días (promedio 7). Cursa con una diarrea aguda
secretora (puede ser mayor de 3 litros/día) con importante pérdida de
electrolitos, dolor abdominal difuso, borborigmos, náuseas, vómitos, hiporexia
y pérdida de peso.
Las heces son líquidas, abundantes, oscuras, malolientes y
en un promedio de 6 / día. En las personas inmunocompetentes la enfermedad dura
3-27 días (se autolimita) y en los inmunocomprometidos mas de 1 mes, pudiendo
llevar a la caquexia y la muerte. Las lesiones histológicas asociadas con la
criptosporidiosis intestinal no son características. El contacto inicial entre
el parásito y el glicocálix de la célula huésped, produce un acortamiento o
ausencia de las microvellosidades, con atrofia y aumento de tamaño de la
cripta. Se observa en la mucosa y hasta la lámina propia un infiltrado
moderado de células mononucleares. El yeyuno es la localización intestinal
en donde existe mayor infección. Se ha encontrado diseminación en pacientes
inmunosuprimidos, principalmente con SIDA, a faringe, esófago, estómago,
duodeno, ileum, colédoco, apéndice, colon, recto y pulmones, en cuyo caso
pueden encontrarse los ooquistes en el esputo. En las personas
inmunocompetentes, el período de incubación varía entre 3 y 12 días. La
sintomatología puede fluctuar entre la sensación de indigestión y un cuadro de
enteritis con diarrea de tipo agudo o crónico. Algunas personas pueden tenerla
infección totalmente asintomática. En otras aparece la diarrea pero la
infección se autolimita. Algunos autores la asocian con el síndrome conocido
como diarrea del viajero. La diarrea generalmente es acuosa, sin moco ni
sangre, la mayoría de las veces sin leucocitos. Se presenta con 5 a 10
episodios diarreicos al día, después de un tiempo puede seguirle la constipación.
En niños con diarrea intensa o crónica, se puede asociar a deshidratación. Los
pacientes se quejan de dolores abdominales, ocasionalmente fiebre, cefalea,
anorexia, vómito y pérdida de peso. Generalmente la enfermedad se autolimita a
10-14 días. En una cuarta parte de los pacientes puede llegar a más de un mes.
La mayoría de los casos no requieren tratamiento antidiarreico. Los parásitos
desaparecen entre 4 y 6 semanas. En los pacientes con SIDA, además de la
localización intestinal, se ha encontrado diseminación con complicación
pulmonar. Causa una neumonía intersticial con intensa tos seca y sibilancias.
Se han informado casos de colecistitis, con colestasis, fiebre, dolor abdominal
y marcada pérdida de peso. Se han comunicado casos de pancreatitis, laringotraqueítis
y sinusitis. La enfermedad es más frecuente en los pacientes con SIDA, pero
también ocurre en otras inmunodeficiencias como hipogammaglobulinemia, terapia
inmunosupresora, desnutrición, leucemia, linfoma y otros defectos de la
inmunidad.
En los pacientes con deficiencias inmunes, los síntomas son
más intensos y de larga duración. La diarrea es crónica y ocurre una enfermedad
debilitante con malestar, anorexia y fiebre. Hay pérdida de líquidos y
electrólitos que pueden causar enfermedad grave o muerte por deshidratación. El
diagnóstico de la criptosporidiosis se hace por el hallazgo de ooquistes en las
materias fecales o en material obtenido del duodeno por la cuerda de Beal
(Entero tests). En las preparaciones con solución salina y lugol se pueden
observar unas estructuras redondeadas u ovoides de pared definida, como
"huecos vacíos", de tamaño uniforme, refringentes, algunas veces con
estructuras granulares internas, que no son fáciles de identificar. La técnica
más precisa es la coloración por el método de Ziehl-Neelsen modificado, sin
utilizar el calentamiento de la placa. Se observan los ooquistes
ácido-resistentes, de color rojo brillante sobre fondo azul. En algunos se ven
unos corpúsculos internos que corresponden a los esporozoítos. Otras
coloraciones que se utilizan son Kinyoun y Giemsa. Para concentrar
ooquistes de Cryptosporidium se realizan las técnicas de Ritchie modificada que
usa formol-éter y la de Sheather que es una flotación con azúcar. Ambas son
similares en efectividad. Es necesario tener precaución en la manipulación de muestras
de pacientes con SIDA. La identificación de los ooquistes también se hace con
inmunofluorescencia directa, para la cual hay estuches comerciales. Existen
también estuches para identificar antígenos específicos de Cryptosporidium por
métodos inmunoenzimáticos. Se han comparado los 3 métodos diagnósticos
más utilizados: visualización de los ooquistes con Ziehl-Neelsen o con
inmunofluorescencia y la identificación de antígenos por ELISA en materia fecal
y se ha encontrado que todos tienen sensibilidad y especificidad de 96% a 98%,
por lo cual la escogencia depende de las posibilidades de los laboratorios y de
los costos de los reactivos. En biopsia intestinal se puede observar la atrofia
de las vellosidades del intestino y la hipertrofia de las criptas, en donde se
localiza el parásito. Se logran definir distintos estadios mediante las
coloraciones comunes de hematoxilina - eosina, en donde se ven de color
violeta. También se usa la técnica de plata - metenamina, Giemsa, Kinyoun y la
inmunoperoxidasa. Es posible también demostrar anticuerpos circulantes con
inmunofluorescencia indirecta y con técnicas de ELISA. En los estudios serológicos
se consideran significativos para el diagnóstico los títulos de 1:40 o
superiores. Análisis de alimentos y otras muestras: Investigación de
ooquistes por microscopía, uso de técnicas de biología molecular. El
tratamiento de base, apunta a un equilibrio del aporte hidroelectrolítico
(reposición de pérdidas) y de nutrientes. Se ha logrado una eficacia del 50 %
en el tratamiento de los adultos con 2-3 g/día de espiromicina durante 7-30
días. Las medidas de prevención y control estarán basadas en las básicas
para casi todas las EPTA:
· Eliminación sanitaria de excretas.
· Provisión de agua segura (filtrada
para eliminar partículas de 0,1-1 um).
· Educación para la salud.
· Los quistes son inactivados por
calentamiento a temperatura de 72ºC durante un minuto o 45ºC durante 10-20
minutos o por congelación.
"SOMOS LO QUE HACEMOS REPETIDAMENTE. EXCELENCIA, POR LO TANTO, NO ES UN ACTO SINO UN HÁBITO"
ARISTOTELES
LEGALES: El autor no asume responsabilidad alguna por la descarga, copia, distribución, modificación o alteración de los contenidos publicados, sean propios del mismo o de terceros, los cuales pudieren estar protegidos por Copyright, Derechos de Propiedad Intelectual, Derechos de Autor, o relacionados. La Bibliografía del tema expuesto y el crédito fotográfico está en poder del Autor y no se publica dada su extensión, pero se enviará por mail al interesado que la solicitare debidamente fundamentada.


Comentarios
Publicar un comentario