Las Enfermedades transmitidas por los alimentos (Parte 7)
Más de una vez Ud. habrá dicho: “Debe ser algo que comí”,
“Algo me cayó mal” ó “Me dio un ataque de hígado”, luego de haber estado con
diarreas, vómitos, dolor de cabeza ó cólicos. Lo más probable es que sí; algo
le cayó mal, y no precisamente lo que comió, sino, lo que no vio al ingerir ese
alimento, ya que éste tenía el aspecto de estar sano, pero...no fue así.- Lo
que usted sufrió fue una Enfermedad Transmitida por los Alimentos (ETA)
LAS ENFERMEDADES TRANSMITIDAS POR LOS ALIMENTOS (Parte 7)
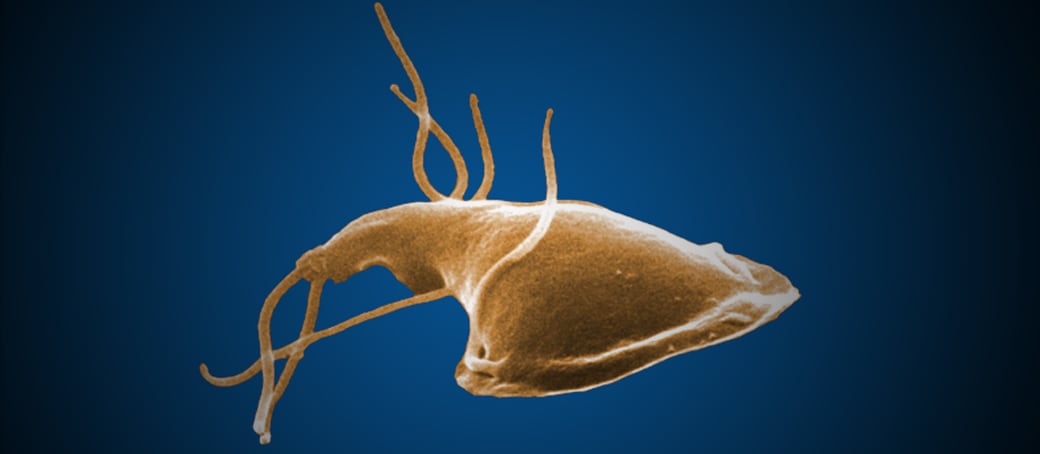
Giardiasis o Giardosis (CIE-10 a07.1)
Es una de las parasitosis más ampliamente difundidas. El agente es
Giardia lamblia o Giardia intestinalis o Giardia duodenalis, protozoario
binucleado flagelado. Tiene una forma de resistencia (quiste) y una vegetativa
(trofozoito). Es endémica y pueden ocurrir brotes. Es una de las causas más
frecuentes de diarrea del viajero. El reservorio está constituido por el
hombre, los animales domésticos (perro, gato), el ganado (bovino, porcino,
ovino, equino) y también animales salvajes (ratas, nutrias, monos, castores,
etc.). Las moscas y las cucarachas pueden vehiculizar los quistes en sus patas,
abdomen y heces. La forma de transmisión es: Por agua y alimentos contaminados.
Directa persona a persona fecal-oral. La incidencia de la enfermedad se
relaciona inversamente con el saneamiento ambiental. Es uno de los primeros
enteropatógenos en infectar a los lactantes y la tasa de incidencia es de 10-30
% en niños menores de 10 años en los países en desarrollo.

Los brotes
comunitarios transmitidos por agua han sido los más frecuentes y es llamativo
que no hayan sido descritos más brotes transmitidos por alimentos (ensaladas
crudas, carnes frías, etc.). La infección ocurre con recuentos de quistes
mayores de 10. Una persona con giardiasis puede eliminar 900 millones de
quistes/día. La giardiasis se transmite mediante la ingestión de los
quistes, que son infectantes tan pronto salen en las materias fecales. Su
diseminación se hace a través de manos sucias, aguas y alimentos contaminados y
por cualquier otro mecanismo que permita la contaminación fecal, como sucede en
la amebiasis y otras infecciones entéricas bacterianas y virales. La
giardiasis puede presentarse en forma epidémica por contaminación de
acueductos, aun en aquellos con tratamiento de cloración. En algunos
países, la prevalencia de Giardia es más alta que la de Entamoeba histolytica.
En países tropicales es una parasitosis frecuente, especialmente en niños. Este
aumento se ha observado con mayor intensidad en los últimos años. Esta
parasitosis intestinal ha aumentado su frecuencia en los últimos años en los
países desarrollados, debido al aumento de viajeros a zonas endémicas y a la
contaminación de agua de bebida. Se ha .demostrado positividad para el parásito
en el 7% de los coprológicos en los laboratorios de salud pública en Estados
Unidos.
En esos países se han encontrado frecuentes casos en personas que
tienen actividades transitorias en el campo, como cazadores, grupos que van de
paseo, etc. en los que la infección puede ser adquirida de reservorios
animales. El parásito fue descubierto por Leeuwenhoek, inventor del
microscopio, quien lo observó en 1681, en sus propias materias fecales. El
trofozoíto de G. intestinalis tiene forma piriforme y en la parte anterior
posee dos núcleos que se unen entre sí en el centro, dando la apariencia de
anteojos. Mide aproximadamente 15 micras de longitud por 7 de ancho. Posee una
cavidad o ventosa que ocupa la mitad anterior de su cuerpo, la cual utiliza
para fijarse a la mucosa intestinal. Posee en su diámetro longitudinal y en la
parte central, una barra doble o axostilo de cuyo extremo anterior emergen 4
pares de flagelos, uno anterior, dos laterales y otro posterior. El axostilo es
atravesado en el centro por dos estructuras en forma de coma llamadas cuerpos
parabasales. Los dos núcleos poseen nucléolos centrales y están unidos entre sí
por los rizoplastos que terminan en el extremo anterior del axostilo, en dos
órganos puntiformes llamados blefaroplastos. El trofozoíto tiene capacidad de
traslación con movimiento lento, vibratorio y a la vez rotatorio, lo cual
permite observar la cavidad correspondiente a la ventosa o disco suctorio.

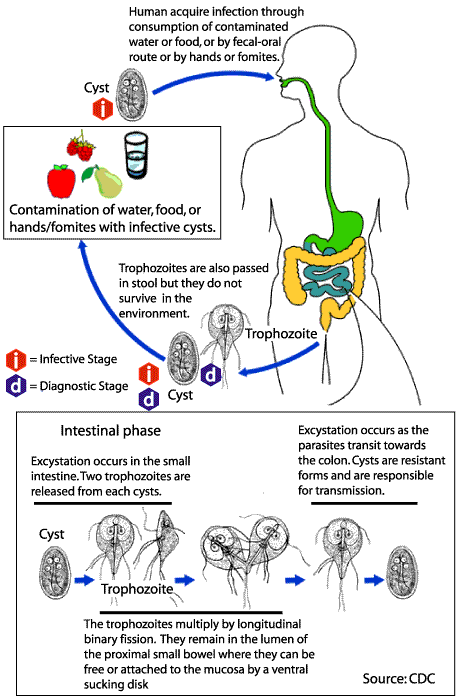
El
quiste tiene forma ovalada con doble membrana, de 2 a 4 núcleos y algunas de
las estructuras descritas para el trofozoíto, de las cuales es notorio el
axostilo. El tamaño pro- medio es de 10 micras de longitud. Los trofozoítos se
localizan en el intestino delgado, fijados a la mucosa, principalmente en el
duodeno. Allí se multiplican por división binaria y los que caen a la luz
intestinal dan origen a quistes. Estos últimos son eliminados con las materias
fecales y pueden permanecer viables en el suelo húmedo o en el agua por varios
meses. Infectan por vía oral y después de ingeridos resisten la acción del jugo
gástrico y se rompen en el intestino delgado para dar origen a 4 trofozoítos
por cada quiste. Los trofozoítos no son infectantes cuando entran por vía oral.
Cuando son eliminados en las heces diarreicas mueren en el exterior. La
infección es principalmente persona a persona, pero se ha comprobado que
algunos animales como perros, gatos, castores y rumiantes, pueden ser
reservorios de G. intestinalis y por consiguiente dan origen a infección en
humanos, en cuyo caso esta parasitosis se puede considerar como una zoonosis.
Los quistes ingeridos con el agua o los alimentos por estimulación del jugo
gástrico, luego por el pH alcalino y las proteasas intestinales liberan los
trofozoítos. Éstos colonizan la parte superior del intestino delgado,
atraviesan la capa de moco y éstos adhieren a la mucosa. El elevado
número de trofozoítos provocaría la disrupción del ribete en cepillo y el
sistema enzimático lo que resultaría en las alteraciones de absorción y la
deficiencia de disacaridasa.

Los quistes aparecen en las heces desde los 6-15
días de la infección. Los trofozoítos se localizan en el intestino delgado,
fijados a la mucosa, principalmente en el duodeno. Allí se multiplican por
división binaria y los que caen a la luz intestinal dan origen a quistes. Estos
últimos son eliminados con las materias fecales y pueden permanecer viables en
el suelo húmedo o en el agua por varios meses. Infectan por vía oral y después
de ingeridos resisten la acción del jugo gástrico y se rompen en el intestino
delgado para dar origen a 4 trofozoítos por cada quiste. Los trofozoítos
no son infectantes cuando entran por vía oral. Cuando son eliminados en las
heces diarreicas mueren en el exterior. La infección es principalmente persona
a persona, pero se ha comprobado que algunos animales como perros, gatos,
castores y rumiantes, pueden ser reservorios de G. intestinalis y por
consiguiente dan origen a infección en humanos, en cuyo caso esta parasitosis
se puede considerar como una zoonosis. El principal mecanismo de acción
patógena en giardiasis se debe a la acción mecánica de los parásitos sobre
la mucosa del intestino delgado, principalmente del duodeno y yeyuno. Esta
acción se hace por fijación de los trofozoítos por medio de la ventosa y da
origen a inflamación catarral.
La patología principal se encuentra en
infecciones masivas, en cuyo caso la barrera mecánica creada por los parásitos
y la inflamación intestinal, pueden llegara producir un síndrome de
malabsorción. En estos casos las vellosidades intestinales se encuentran
atrofiadas, hay inflamación de la lámina propia y alteraciones morfológicas de
las células epiteliales. Algunos casos de giardiosis graves se han asociado con
la presencia de hiperplasia nodular linfoide en intestino delgado y grueso. No
se acepta que haya invasión a vías biliares y por consiguiente no es correcto
atribuirle patología hepatobiliar a esta parasitosis. Se han encontrado
anticuerpos séricos en infecciones sintomáticas y se ha sugerido que puede
haber alguna resistencia a la infección, debido a mecanismos
inmunológicos. La importancia de la inmunidad en giardiosis puede ser
sustentada por varios hallazgos:
a). La prevalencia es menor en adultos que en niños de zonas endémicas y
también mayor en visitantes a estas zonas cuando se comparan con los nativos de
la región,
b). Hay una prevalencia mayor en personas inmunocomprometidas,
especialmente en hipogammaglobulinemia,
c). Modelos animales se infectan más fácilmente y sufren de giardiosis
crónica, cuando son atímicos o cuando se tratan con drogas inmunosupresoras y
d). Se pueden detectar anticuerpos séricos en pacientes con giardiosis.
Los anticuerpos IgA específicos para Giardia se han encontrado
experimentalmente en animales, en secreciones mucosas, leche y saliva. La IgE
total en suero está aumentada en casos de giardiosis. En el intestino de
ratones parasitados por Giardia muris se han encontrado anticuerpos IgG e IgA,
adheridos a los trofozoítos y en el contenido intestinal. El periodo de incubación
es de 3-25 días (mediana 7-10 días). La enfermedad puede ser abortiva,
transitoria o crónica. El 50 % de los infectados presentan síntomas y
alrededor del 15 % es asintomático por el pasaje de quistes. La duración
de la infección en los asintomáticos puede ser hasta de 6 meses. La infección
aguda cursa con diarrea aguda líquida o semilíquida con moco, fétida,
hipocólica y a veces de aspecto graso. Puede acompañarse de náuseas, dolor
abdominal epigástrico o postprandial, distensión, flatulencia, hiporexia,
eructos, pérdida de peso. Los vómitos, la fiebre y el tenesmo tienen una
frecuencia menor del 15 %. Los hallazgos clínicos característicos son la
diarrea prolongada y la pérdida de peso en el 50 % de los afectados. Puede
ceder espontáneamente en 4 días-6 semanas o mantenerse por meses o años. En los
menores de 5 años los síntomas son más importantes. En los niños no es una
enfermedad autolimitada, tiende a la cronicidad. La infección crónica
evoluciona con malestar, lasitud, dolor abdominal difuso, malestar relacionado
con la ingesta, y a veces, cefalea. Alternan períodos de diarrea con otros de
constipación o hábitos normales.
El sindrome de malabsorción (proteínas,
lactosa, vitaminas A y B) es una complicación. En todas las edades se pueden
encontrar casos asintomáficos. La sintomatología presenta grados variables de
acuerdo a la intensidad de la infección y a la deficiencia inmunológica. Los
mecanismos patogénicos, además de la actividad mecánica, se deben a otros
factores como: secreción de sustancias citopáticas, inhibición de actividad
enzimática de las disacaridasas (lactasa, sucrasa y maltasa) y de tripsina y
lipasa, desconjugación de las sales biliares, incremento de la flora bacteriana
y trastornos en el transporte de cloro y sodio. Las formas leves se
caracterizan por dolor epigástrico de poca intensidad y alteración en el ritmo
de la defecación. Las formas moderadas se manifiestan por un cuadro de
duodenitis, con dolor frecuente en región epigástrica, a veces náuseas,
flatulencia y diarrea. La giardiosis severa presenta, además de la duodenitis,
esteatorrea o lientéria con heces abundantes, pastosas o líquidas de muy mal
olor, lo que se asocia con flatulencia. En casos crónicos con
malabsorción, los niños presentan retardo del crecimiento y pérdida de peso. La
diarrea crónica contribuye a la deficiencia proteica. Los síntomas intestinales
pueden estar asociados a sintomatología general inespecífica, como anorexia,
astenia, cefalea, náuseas y vómito. El diagnóstico clínico diferencial debe hacerse
con otras causas de duodenitis o diarrea y con las enfermedades que producen
malabsorción, como enfermedad celiaca y sprue tropical. El diagnóstico
etiológico sólo puede hacerse por identificación del parásito. El método más
utilizado es el examen coprológico, que en la mayoría de los casos revela los
quistes; en algunos casos de diarrea se observan trofozoítos, los cuales se ven
en solución salina con movimientos vibratorios y giratorios, que permiten
observar la muesca correspondiente a la ventosa. En las infecciones leves se
deben hacer coprológicos seriados y examen por concentración para confirmar la
presencia de los parásitos, pues un solo examen tiene poca sensibilidad. El
estudio microscópico del líquido duodenal obtenido por sondaje, puede demostrar
los trofozoítos. Este procedimiento no se justifica establecerlo de rutina como
reemplazo del examen coprológico, sino que tiene utilidad en casos de
difícil diagnóstico o cuando se obtiene líquido duodenal para oíros fines. En
infecciones leves el líquido duodenal puede ser positivo y el coprológico
negativo. La cápsula de Beal o de la cuerda de nylon (Entero-Test®), es de
utilidad en el diagnóstico, la biopsia intestinal muestra los cambios en las
vellosidades y ocasionalmente permite ver los parásitos. Este procedimiento no
debe ser de rutina y sólo se usa en casos especiales. El estudio
radiológico no es de utilidad en la giardiosis, aunque se pueden producir
cambios no específicos de la morfología duodenal. Los cultivos para Giardia son
difíciles de realizar y por lo tanto no se utilizan como métodos de
diagnóstico. La identificación de anticuerpos circulantes no es útil como
método diagnóstico. Se han descrito métodos inmunológicos para detectar
antígenos del parásito en materias fecales, con sensibilidad y
especificidad de 98 y 100%. Este procedimiento, que se puede realizar con
estuches comerciales de ELISA, es más eficiente que el examen coprológico, pero
de mayor costo. Los derivados 5-nitroimidazólicos son los de elección en
giardiosis. La tolerancia es buena, aunque en aproximadamente la cuarta
parte de los casos produce síntomas leves, principalmente sabor metálico y
molestias digestivas. El tinidazol a la dosis de 2 g para adultos y 60 mg/ kg
para niños, en dosis única, presenta eficacia similar al secnidazol.
Estos dos
medicamentos tienen la ventaja de encontrarse, además de tabletas, en
suspensión para niños. El ornidazol se presenta únicamente en tabletas y se
recomienda la dosis única de 1.5 g para adultos y niños con más de 35 kg de
peso. El metronidazol siempre se ha recomendado en tratamiento de varios días y
en giardiosis la dosis es de 500 mg/día subdividido en 3 subdosis al día para
adultos y 25 mg/ kg/día para niños, por 5 días. Se presenta en tabletas y
solución en jarabe para niños. El albendazol, descrito ampliamente como
antihelmíntico, es efectivo en giardiosis a la dosis de 400 mg/día por 5 días. La
furazolidona, usada en diarreas bacterianas, se emplea también en esta
parasitosis a la dosis de 5 mg/kg/día en niños, dividida en 4 tomas diarias por
7 días. Puede producir intolerancia digestiva y síntomas generales, así como
reacción disulfiram con alcohol. Esta droga presenta desventajas cuando se
compara con las anteriores. La quinacrina (mepacrina o atebrina) es la droga
recomendada en Estados Unidos y en otros países donde no se han comercializado
los nitroimidazoles. La dosis es 100 mg 3 veces al día en adultos y 2 mg/kg, 3
veces al día en niños por 5 ó 7 días. Puede producir efectos colaterales y
toxicidad. Investigaciones recientes han revelado que cepas de Giardia aisladas
de pacientes que no se han curado con metronidazol, son resistentes in
vitro a esta droga. Estos hallazgos y la publicación de algunos casos que
no se han curado con los nitroimidazoles son una voz de alerta sobre la posible
resistencia de los protozoos a estos medicamentos.
Toxoplasmosis (cie-10-b 58)
Es una toxiinfección ampliamente diseminada en numerosas especies
animales y el hombre. El agente causal fue identificado en 1908 pero la
importancia de la infección crónica y la prevalencia se reconocieron en los
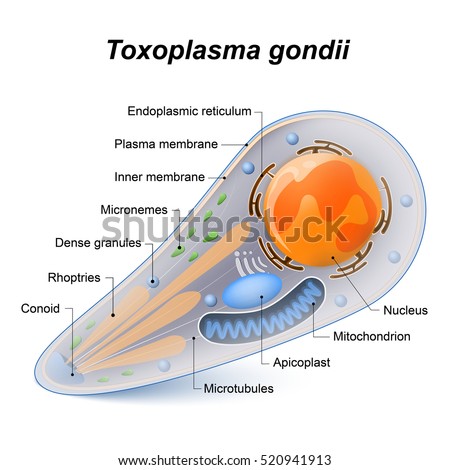
'50. Toxoplasma gondii es un protozoario coccidio (clase Sporozoea subclase
Coccidia, familia Sarcocystidae, Subfamilia Toxoplasmatinae, género Toxoplasma,
especie gondii) parásito intracelular obligado. Presenta tres genotipos: el II
es el que afecta al hombre y el III es más frecuente en los animales. Tiene
tres formas: taquizoíto o endozoíto (forma proliferativa por endodiogenia en la
fase aguda de la enfermedad), quiste hístico con una membrana formada por el
parásito y que contiene alrededor de 3.000 bradizoítos (reproducción lenta
también por endodiogenia), ooquiste (resultado de la reproducción sexuada en el
intestino de los felinos). Es una zoonosis de distribución universal. Los
huéspedes definitivos o completos del parásito son los felinos (gato, gato
montés, puma, lince, etc.) y los huéspedes intermediarios o incompletos, el
hombre y las aves. El principal reservorio es el gato que se contagia por el
consumo de otros animales infectados (roedores, aves). En el intestino de los
felinos se cumple el ciclo sexual del parásito y eliminan diariamente millones
de ooquistes hasta tres semanas después de la infección. El 25-45% de los gatos
son seroreactivos y el 1 % excreta ooquistes.
Las encuestas
seroepidemiológicas revelan que alrededor del 50 % de los adultos han adquirido
la infección. La mayoría de las infecciones se adquieren por el consumo de
tejidos de mamíferos (porcino, ovino, caprino, bovino, etc.) crudos o insuficientemente
cocidos que contienen bradizoítos (quistes tisulares) o por el agua y los
alimentos contaminados con ooquistes eliminados en las heces de los gatos
parasitados y, raramente, por la leche de cabras y de vacas infectadas que
pueden contener taquizoítos. Los vectores mecánicos coprófagos (moscas,
cucarachas) pueden contaminar los alimentos. La destrucción de la membrana
quística por digestión libera los trofozoítos que penetran en las células del
sistema reticuloendotelial. Se multiplican activamente en el interior de la
célula y la ocupan dando un pseudoquiste que se rompe y libera los parásitos
que invaden otras células del mismo tejido o se diseminan por vía
linfohemática. En esta última eventualidad, se producen adenitis regional y la
parasitemia puede durar horas o días. La respuesta immune provoca la
destrucción de los trofozoítos libres y la multiplicación intracelular se
enlentece. La inmunidad específica está mediada por anticuerpos y linfocitos T.
Los anticuerpos Ig M aparecen a partir de la primera semana de infección y los
Ig G desde la segunda semana. Otras vías de transmisión son: vertical
(madre-hijo), transfusional y por transplante de órganos. Toxoplasma gondii,
fue descubierto en 1908 por Nicolle y Manceaux, en Túnez, en el roedor africano
Ctenodactylus gundi; simultáneamente Splendore en Brasil lo encontró en
conejos. Durante aproximadamente 30 años, el parásito fue poco conocido y no se
le dio importancia desde el punto de vista humano. Janku en 1923, en Praga,
descubrió la coriorretinitis toxoplasmósica y se informó el primer caso en una
niña recién nacida. Posteriormente Wolff y colaboradores en 1939
demostraron que el parásito causaba meningoencefalitis congénita. Un paso muy
importante para el diagnóstico de la infección se dio en 1948, cuando Sabin y
Feldman establecieron una reacción serológica.
Un año después Frenkel descubrió
una prueba de hipersensibilidad, útil tanto para el diagnóstico de las formas
crónicas como para los estudios epidemiológicos. En 1970, Frenkel en Estados
Unidos y Hutchison, en Inglaterra, lograron establecer su verdadera forma de
transmisión en la naturaleza, al encontrar que T. gondii era un parásito del
intestino de los gatos y las formas infectantes salían en las materias fecales
de estos animales. Su nombre se deriva de la palabra griega "toxon",
que significa arco, por su morfología curva o de medialuna. En la infección
aguda se encuentra la forma proliferativa o taquizoíto, término que se refiere
a los parásitos extraepiteliales que se multiplican rápidamente. Su tamaño es
de 4 a 6 micras de longitud, por 2 a 3 de ancho. Cuando se hacen coloraciones
con Wright o Giemsa, además de observar su forma arqueada, con un extremo más
delgado, se encuentra que su citoplasma se tiñe de azul pálido y su núcleo
paracentral, de color rojizo. Al microscopio electrónico se observa la morfología
característica en medialuna. En las infecciones crónicas los quistes son las
formas predominantes. Estos aparecen en el ciclo de vida del parásito,
inducidos por el estado inmunitario del huésped. Los quistes poseen una
membrana propia y miden entre 20 y 200 micras, de forma generalmente
redondeada, algunas veces alargada. En su interior se encuentran cientos de
parásitos conocidos como bradizoítos, término que señala los elementos
extraepiteliales que se forman por multiplicación lenta. El ciclo de T. gondii
corresponde al de las Coccidias, las cuales presentan un ciclo
entero-epitelial, en donde aparecen formas sexuadas y asexuadas. El gato y
algunos felinos son los huéspedes definitivos de T. gondii. El taquizoíto mide
6 micras de longitud por 2 de ancho. Su forma es alargada y un poco arqueada,
con una membrana externa compuesta por laminina unida a proteínas y otra
membrana interna, ambas interrumpidas en uno de sus lados por el microporo. El
núcleo se tiñe con facilidad con colorantes comunes. Al microscopio electrónico
se observan varias estructuras semejantes a las mencionadas para
los merozoítos de Plasmodimn, ya que ambos parásitos tienen las
características del filum Apicomplexa. En el citoplasma se les visualiza el
citoesqueleto con los microtúbulos y en la paite anterior se localizan las
roptrias y los anillos polares. Tienen, además, los micronemas, mitocondrias,
aparato de Golgi y varios gránulos. En el intestino tiene reproducción sexuada
y luego se desarrollan los ooquistes que salen con las materias fecales. Estos
miden de 10 a 12 micras y son casi esféricos.
En el medio ambiente los
ooquistes maduran en 1 a 2 días y en su interior se forman 2 esporoquistes,
cada uno de los cuales contiene 4 esporozoitos. En el gato y otros felinos, además
del ciclo enteroepitelial, también pueden coexistir invasiones
extraintestinales, pues los taquizoítos por vía linfática o sanguínea se
diseminan a todos los órganos en donde se forman quistes. El hombre y los
animales se infectan mediante la ingestión de los ooquistes procedentes de las
materias fecales de gato o de las formas quísticas presentes en tejidos de
otros animales, en los cuales ocurren invasiones extraintestinales haciendo un
ciclo incompleto, como huéspedes intermediarios. En estos casos existe
inicialmente una infección aguda con reproducción intracelular de los
taquizoítos. Cuando el huésped desarrolla inmunidad la infección se hace
crónica y se forman los quistes con los bradizoítos. Los felinos se infectan al
ingerir ooquistes y después de 20 a 24 días aparecen nuevas formas infectantes
del parásito que salen en materias fecales. Si el animal ingiere tejidos con
bradizoítos enquistados, como ocurre al comer un ratón infectado, el período
prepatente se reduce 3 ó 4 días. La severidad del síndrome clínico es
determinada por el grado de necrosis celular y de la reacción inflamatoria. El
daño producido por el parásito en la fase aguda depende del número de
taquizoítos que proliferan en las células. En la fase crónica ocurre una
reacción de hipersensibilidad al romperse los quistes con salida de antígenos
que reaccionan localmente. El parásito penetra la pared intestinal y siguiendo
la vía linfática o hemática se disemina a una gran variedad de tejidos. Los
taquizoítos se reproducen intracelularmente y pasan de célula a célula
causándole la muerte, esta proliferación constituye la forma activa de la
toxoplasmosis. La diseminación a los diferentes órganos se hace a partir del
sitio de la infección, pasando a la circulación directamente o llevados por
macrófagos, linfocitos o granulocitos.
En infecciones accidentales de
laboratorio, se ha observado que después de la lesión aparece linfoadenitis
regional con posterior diseminación hematógena. Después de 1 a 2 semanas,
cuando se desarrolla la inmunidad, la proliferación del parásito disminuye y
comienzan a aparecer bradizoítos enquistados en los tejidos. Los parásitos
intracelulares forman su propia pared, dando origen a los quistes, que cuando
están íntegros, no tienen reacción inflamatoria alrededor. En los tejidos,
estos quistes son semejantes a los de otros protozoos. Los ganglios están
aumentados de tamaño, hay hiperplasia de las células reticulares, semejantes a
un granuloma, a veces con células epitelioides, principalmente en los folículos
germinativos. Raras veces se encuentra el parásito en los cortes histológicos y
para su hallazgo es necesario hacer una intensa búsqueda. Cuando hay
diseminación a los pulmones, los macrófagos alveolares y otras células pueden
estar parasitadas. Aparecen focos de necrosis, pero no se forman abscesos o
cavidades. En el hígado se ha descrito hepatitis toxoplasmósica. En el sistema
nervioso central, T. gondii produce encefalitis, más frecuente en pacientes
inmunosuprimidos. Hay invasión de taquizoítos a las células nerviosas, más
adelante hay reacción inflamatoria en los nódulos gliales, muerte de las
células produciendo zonas de infarto, calcificaciones y generalmente abundantes
quistes, con poca o ninguna reacción inflamatoria alrededor, cuando no se han
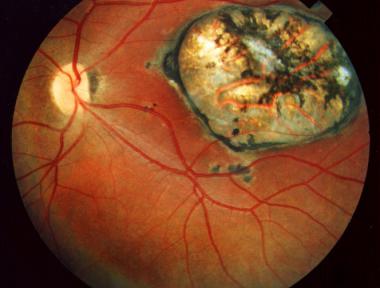
roto. Los ojos constituyen una localización importante y frecuente del
parásito. Se produce retinocoroiditis o uveítis anterior granulomatosa, intensa
inflamación de la retina, presencia de quistes y cicatrizaciones. La retina y
la coroides muestran varios grados de necrosis y dentro de las células
retinianas se observan los parásitos, en su mayoría en forma quística. Cuando
existe necrosis retiniana se observan gránulos dispersos derivados del pigmento
epitelial, infiltración linfocitaria perivascular, edema, gliosis y
degeneración de la membrana. Si hay ruptura del quiste, el infiltrado leucocitario
es abundante. La necrosis celular por los taquizoítos da una menor
inflamación que la ruptura de quistes, los cuales liberan sustancias
antigénicas que desencadenan hipersensibilidad, con extensas áreas
inflamatorias. En el embarazo, cuando existe diseminación hematógena, se puede
infectar la placenta, en donde se forman acúmulos de taquizoítos y quistes en
corion, decidua y cordón umbilical. En algunos casos pueden ocurrir abortos o
mortinatos. En el feto existe invasión de taquizoítos a las vísceras,
incluyendo el sistema nervioso central. La necrosis tisular ocurre por infarto,
al existir un daño vascular.

Las lesiones ocurridas alrededor del acueducto de
Silvio y de los ventrículos llegan a causar alteraciones en la circulación del
líquido, con obstrucción, aumento de la presión intracraneana, daño de los
tejidos por la compresión e hidrocefalia. Microscópicamente se comprueba la
necrosis y la infiltración inflamatoria de polimorfonucleares, linfocitos,
proliferación glial y depósitos de calcio alrededor de los capilares o de
neuronas. El parásito persiste dentro de los quistes; si éstos se rompen
aparece una intensa reacción inflamatoria a su alrededor. El período de
incubación es de 5-23 días. La mayoría de las infecciones son asintomáticas. Se
estima que hasta el 20 % de las personas inmunocompetentes tienen
manifestaciones clínicas. Puede cursar como un sindrome mononucleósico
autolimitado: formas ganglionar (adenomegalias de la cadena cervical) y
exantemo-ganglionar (adenomegalias y exantema, habitualmente
eritemato-máculo-papular) con síntomas generales como febrícula/fiebre,
odinofagia, astenia y hepatomegalia. La infección aguda excepcionalmente
presenta otras manifestaciones como hepatitis, neumonitis, miocarditis,
encefalitis, coriorretinitis. En los huéspedes inmunodeficientes la
infección es grave y afecta el sistema nervioso central y el miocardio. La
mayoría de las infecciones transcurren en forma asintomática o con ligera
sintomatología no específica. Son frecuentes los hallazgos ocasionales de
anticuerpos circulantes, sin que previamente hubieran existido síntomas de la
infección inicial. Las infecciones crónicas son más frecuentes que las agudas.
Las principales formas clínicas de la enfermedad son: La forma aguda
generalizada o febril exantemática es rara y con frecuencia no se diagnostica.
Después de un período de incubación de unos 5 a 18 días, aparece bruscamente un
síndrome febril de tipo séptico, con fiebre alta, escalofríos, sudoración,
cefalea, astenia y anorexia, rara vez exantema. Es frecuente, además, el dolor
faríngeo, tos y expectoración. En los casos severos se presentan trastornos
gastrointestinales, como dolor abdominal, náuseas, vómito, diarrea o
constipación. Existe compromiso de los ganglios mesentéricos, los cuales
aumentan de tamaño. Si la vía de entrada por inoculación accidental es la mano,
aparece linfoadenitis epitroclear y axilar y al tercer día erupción cutánea
maculopapular generalizada, no pruriginosa, sin compromiso de palmas y plantas.
Con frecuencia se presentan mialgias y artralgias. En los casos severos la
enfermedad se puede manifestar clínicamente como una encefalitis, hepatitis o
miocarditis. Es la forma clínica más común de la toxoplasmosis adquirida y se
presenta principalmente en niños y adultos jóvenes. Puede transcurrir
inicialmente en forma asintomática o con ligeros síntomas. El período de
incubación varía entre 2 semanas y 2 meses. El cuadro clínico más frecuente es
un síndrome febril con las características descritas en la forma aguda, en el
cual predominan las poliadenopatías. Los ganglios linfáticos más fácilmente
reconocibles son los cervicales, suboccipitales, de la cadena espinal y con
menor frecuencia en otros sitios. Los ganglios están aumentados de
tamaño, de consistencia dura y dolorosa. A veces está asociada a faringitis de
tipo granulomatoso. En general, la evolución es benigna, pero después de varias
semanas o meses, desaparece el cuadro característico pero persiste por mucho
tiempo la astenia y las adenopatías. Excepcionalmente existen complicaciones
graves. Durante la enfermedad se presenta anemia moderada y leucopenia con
linfomonocitosis, que tarda varios meses en desaparecer. La toxoplasmosis
ganglionar puede confundirse con mononucleosis infecciosa, por este motivo se le
llama también forma pseudomononucleósica. Las pruebas serológicas hacen el
diagnóstico diferencial entre las dos entidades. Existen también formas más
benignas en las que prima el cuadro ganglionar, pero con fiebre baja o sin
ella. Generalmente esta forma es transitoria y en muchos casos pasa inadvertida
para el paciente. La toxoplasmosis ocular aparece a cualquier edad y se
considera que puede ser debida a una infección prenatal, con recidivas
posteriores. La localización ocular de la toxoplasmosis adquirida después del
nacimiento es rara. La complicación a nivel ocular puede aparecer tanto por
infecciones agudas como crónicas. La lesión ocular se caracteriza por
inflamación granulomatosa del tracto uveal, la cual comienza por la retina y
luego compromete la coroides.
Esta inflamación dura semanas o meses. La
retinocoroiditis por lo general es unilateral, de preferencia en la región
macular. La lesión es casi siempre redondeada con bordes pigmentados y la parte
central blanquecina. En casos severos se puede presentar desprendimiento de
retina y vitreo hemorrágico. Cuando la madre se infecta por primera vez durante
el embarazo, los parásitos invaden las células y se presenta parasitemia por
donde se hace invasión a todos los órganos, incluyendo la placenta y por lo
tanto existe el riesgo de transmisión congénita en el 65% de los fetos cuyas
madres tuvieron la infección en el último trimestre. Esta cifra baja a
25% y 17%, cuando la infección fue adquirida en el segundo y primer trimestres.
La infección en la madre es generalmente benigna o transcurre asintomática. Si
la infección fue adquirida antes de la gestación, el niño no desarrolla
infección congénita. También se acepta que una madre que dio a luz un niño con
toxoplasmosis, no vuelve a tener otro con la enfermedad. Se han descrito casos
de abortos o mortinatos en infecciones recientes, pero no hay evidencia
definitiva de abortos a repetición, asociados a la toxoplasmosis. La infección
congénita ocurre casi exclusivamente cuando la mujer embarazada adquiere la
infección siendo seronegativa. De los recién nacidos infectados, 70% son
asintomáticos. 20% tienen una forma aguda generalizada o secuelas
neurológicas y el 10% presentan compromiso ocular solamente. Los síntomas que
aparecen en el recién nacido dependen del momento de la infección del feto.
Existen 3 etapas: infección generalizada, encefalitis aguda y secuelas
irreversibles. El diagnóstico serológico es por la Prueba de Sabin Feldman o
Dye test (detecta Ig G, se positiviza a partir de la segunda semana);
inmunofluorescencia indirecta (Ig M reactiva a partir del 5o día, Ig G); ELISA
para Ig M, Ig G, Ig A e Ig E; aglutinación por inmunoabsorción o técnica de
inmunocaptura (ISAGA) detecta anticuerpos Ig M, Ig A; hemaglutinación indirecta
( para control y encuestas de prevalencia): hemaglutinación directa (no se usa
como método único); fijación de complemento (escasa utilidad). Los anticuerpos
Ig M se mantienen detectables alrededor de un año. La toxoplasmosis es una
enfermedad de difícil diagnóstico parasitológico, pues no es fácil demostrar el
agente etiológico y establecer la relación entre infección y enfermedad.
.jpg)
Clínicamente
se debe diferenciar de varias entidades, de acuerdo a la localización de las
lesiones predominantes. En la toxoplasmosis aguda se requiere hacer un
diagnóstico diferencial con cualquier síndrome febril con o sin exantema,
especialmente con aquellos que presentan adenopatías, como mononucleosis
infecciosa, por tener cuadros clínicos que se confunden. También se pueden
comportar como una fiebre tifoidea o una brucelosis. La forma ganglionar semeja
con frecuencia linfomas incipientes. En los casos severos que presentan
encefalitis, hepatitis, neumonitis o miocarditis, se deben descartar otras
etiologías que tengan estos mismos cuadros clínicos. Cuando existe compromiso
ocular, es necesario considerar todas las causas de uveítis endógena, en especial
tuberculosis, histoplasmosis, sífilis y citomegalovirus. La toxoplasmosis
congénita presenta una amplia gama de manifestaciones clínicas, según la
intensidad de la infección, el momento de su aparición y las secuelas. En el
recién nacido se deben descartar enfermedades como sífilis, sepsis,
eritroblastosis fetal, infecciones por virus de inclusión citomegálica y otras
entidades. En todo niño con encefalitis es necesario pensar en toxoplasmosis.
El laboratorio es básico para definir la etiología de la enfermedad.
Tratamiento: Está indicado sólo en la infección aguda en la gestante, el
inmunocomprometido y en la complicada. De elección, pirimetamina+sulfadiazina;
alternativa, clindamicina+espiromicina. Las dosis son: pirimetamina 1 mg/kg/día
por 3 días y la de mantenimiento 1 mg/kg/día, sulfadiazina 75-100 mg/kg/día en
dos dosis; espiramicina 100 mg/kg/día en dos dosis. Cuando se utiliza
pirimetamina se debe agregar ácido folínico 5-10 mg tres días/semana. Las
medidas de profilaxis primaria en las personas susceptibles, de particular
interés en embarazadas e inmunocomprometidos son:
- Comer la carne bien cocida (temperatura mayor de 66º C el tiempo suficiente.
- No consumir leche no pasteurizada ni huevos crudos.
- Usar guantes durante la preparación de alimentos crudos, la realización de tareas de jardinería y la limpieza de las heces y arena o piedras donde defeca el gato.
- Alimentar al gato con alimentos secos, enlatados o hervidos y evitar la caza.
- Evitar el contacto con gatos vagabundos.

"SOMOS LO QUE HACEMOS REPETIDAMENTE. EXCELENCIA, POR LO TANTO, NO ES UN ACTO SINO UN HÁBITO"
ARISTOTELES
LEGALES: El autor no asume responsabilidad alguna por la descarga, copia, distribución, modificación o alteración de los contenidos publicados, sean propios del mismo o de terceros, los cuales pudieren estar protegidos por Copyright, Derechos de Propiedad Intelectual, Derechos de Autor, o relacionados. La Bibliografía del tema expuesto y el crédito fotográfico está en poder del Autor y no se publica dada su extensión, pero se enviará por mail al interesado que la solicitare debidamente fundamentada.


Como ciudad planificada, Milton Keynes tiene un exceso de vegetación y más de 20 millones de árboles individuales. https://lrt-editions.com/15-mejores-cosas-que-hacer-en-milton-keynes-buckinghamshire-inglaterra/
ResponderBorrar