ETA (Enfermedades de transmisión alimentaria) Parte 6
"La ciencia más útil, es aquella cuyo fruto, es el más comunicable"
ENFERMEDADES de TRANSMISIÓN ALIMENTARIA (Parte 6)


- El saneamiento básico (provisión de agua segura y eliminación sanitaria de excretas)
- La educación para la salud (hábitos higiénicos, manejo higiénico de los alimentos).
- La cloración no destruye los quistes, el agua no potable debe alcanzar temperatura de ebullición durante un minuto. También pueden utilizarse para pequeñas cantidades, 8 gotas de tintura de yodo al 2 % ó 12, 5 ml de una solución saturada de cristales de yodo por litro de agua y dejar actuar durante 10 minutos o 30 minutos si el agua está fría, antes de su consumo.
- Tratamiento de los portadores identificados.
Es una enfermedad emergente. Los primeros casos fueron descritos en 1976 y desde mediados de la década del '80, han ocurrido epidemias transmitidas por agua en distintas comunidades. Cryptosporidium parvum, coccidio del subreino Protozoa es el causante. Se han identificado dos genotipos: el 1 (o humano) exclusivamente del hombre y de los primates no humanos y el 2 en el ganado y el hombre, lo que podría indicar que serían dos especies con ciclos exclusivos de transmisión. La dosis infectante es baja (hasta un quiste) y en promedio 132. Tiene distribución universal. La mayor ocurrencia se observa en primavera lo cual estaría relacionado con el aumento de las precipitaciones y la posibilidad de contaminación de las fuentes de agua. Ha sido encontrado en el 87 % de las muestras de agua en los Estados Unidos y Canadá. La infección se adquiere por vía oral y es de origen fecal. Puede proceder de personas infectadas que contaminan a través de manos, contaminación oro-anal, aguas, hortalizas, etc. La infección también puede transmitirse por materia fecal de animales que sufran la parasitosis. Los animales reservorios son muchos, por lo cual se considera una zoonosis frecuente. Los ooquistes son muy resistentes a las condiciones del medio ambiente y pueden sobrevivir en el suelo por varios meses.
En pacientes con SIDA en Colombia, el 45.3% de los que tenían diarrea fueron positivos para Cryptosporidium en materia fecal y en Venezuela el 41.3%. En contraste, sólo de 4% a 5% fueron positivos en casos similares de Estados Unidos. En el año 2000 el número de personas infectadas por VIH en el mundo era de 38 millones y han llegado casi a 40 millones a finales de 2014. Estas cifras alarmantes, que aumentan permanentemente, hacen necesario que se establezcan medidas de control para los agentes oportunistas que ya son más de 100. En pacientes inmunocompetentes la diarrea generalmente es autolimitada y no requiere tratamiento. El problema grave de la diarrea se presenta en los inmunosuprimidos. El reservorio primario está constituido por el ganado bovino y animales domésticos y el hombre. La transmisión es por contaminación fecal del agua y los alimentos (vegetales, frutas, leche no pasteurizada), también ocurre de persona a persona y de animales al hombre. Los quistes eliminados son infectantes y se mantienen durante 2-6 meses. Han sido comunicados numerosos brotes que afectaron 415.000 personas desde 1984. El más importante ocurrió en Milwaukee (Wisconsin, Estados Unidos) con 403.000 personas con diarrea. La modificación del estándar de turbidez del agua potable (Menos de 0,17 unidades nefelométricas), sin embargo, no impidió el brote de Las Vegas.

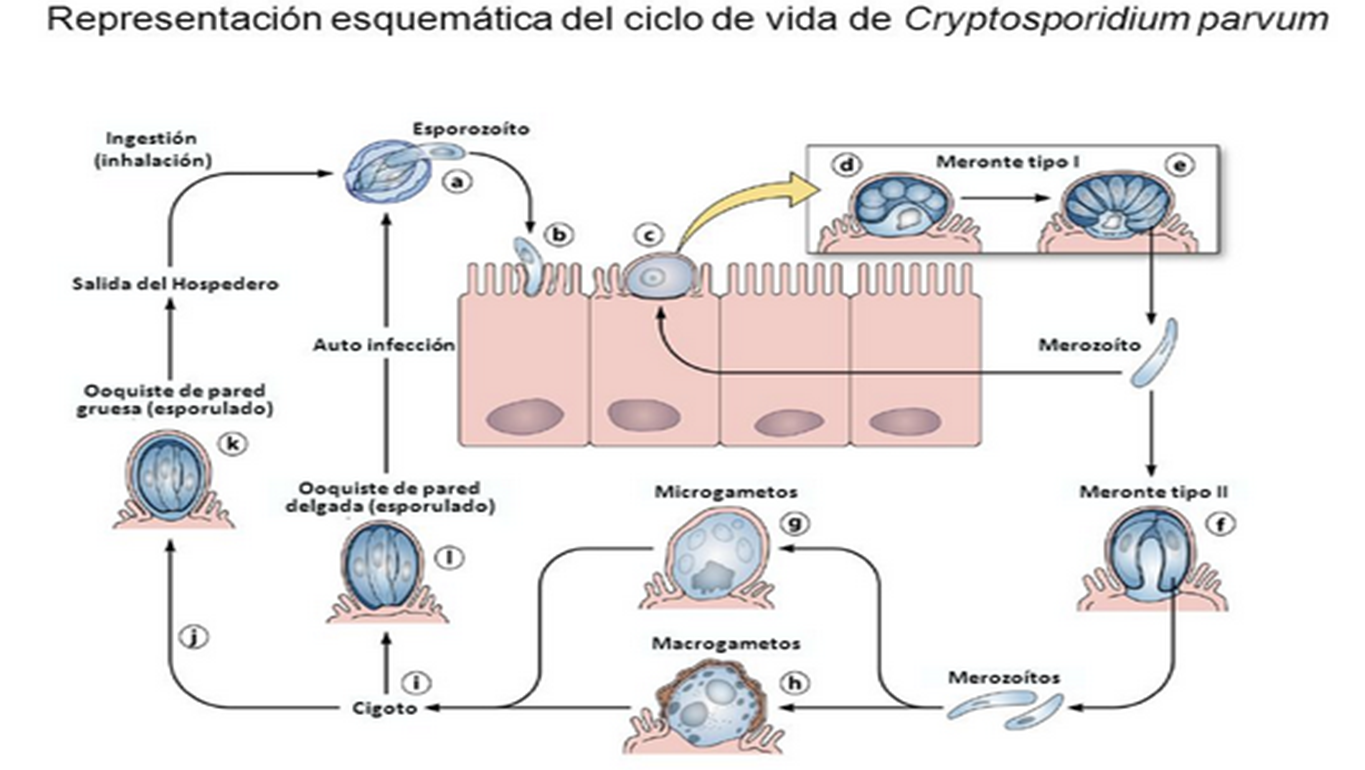
Un siglo después de su descubrimiento y después de casi tres décadas de intensas investigaciones, Cryptosporidium sigue siendo, en muchos aspectos, un enigma. Perteneciente al phylum Apicomplexa, posee como otros coccidios entéricos de vertebrados un ciclo de vida monoxeno que se completa primariamente en el tracto gastrointestinal de un solo huésped. Sin embargo, posee características únicas que lo distinguen de otros coccidios. La localización peculiar dentro de la célula huésped, intracelular pero extracitoplasmática, que confina los estadios de desarrollo endógeno a la superficie apical de las células epiteliales; la unión del parásito a la célula huésped a través de una organela multimembranosa en la base de la vacuola parasitófora que facilita la incorporación de nutrientes desde la célula huésped; la presencia de dos tipos morfofuncionales de ooquistes, los de paredes gruesas que son excretados, y los de paredes delgadas, responsables de la iniciación del ciclo autoinfectivo en el huésped infectado; el tamaño pequeño de los ooquistes que carecen de estructuras morfológicas tales como micrópilo, esporoquistes y gránulos polares y, finalmente la insensibilidad a todos los agentes anticoccidiales probados. Los coccidios del género Cryptosporidium tienen un ciclo de vida monoxeno pues todas las etapas de su desarrollo (sexual y asexual) se completan dentro del tracto gastrointestinal de un único huésped.
Presentan un estadio exógeno que corresponde a los ooquistes esporulados excretados por las heces de los huéspedes infectados, u otros materiales biológicos como las secreciones respiratorias. El diámetro de cada ooquiste varía entre 4 y 6 μm. La fase endógena del ciclo comienza una vez que el huésped apropiado ingiere (o inhala) los ooquistes que contienen cuatro estadios haploides o esporozoítos, los cuales escapan a través de una fisura que se abre en la pared del ooquiste. Al parecer las fluctuaciones de pH en el tracto gastrointestinal, las sales biliares, las enzimas pancreáticas y la temperatura favorecen el desenquistamiento, probablemente, a causa del aumento de la permeabilidad de la pared del ooquiste, la movilidad de los esporozoítos dentro del ooquiste y la consecuente exposición de receptores. El esporozoíto se adhiere a receptores de la membrana apical de la célula epitelial del huésped mediante diversos ligandos, GP900, P23, CP47, entre otros. Este proceso induce la reorganización del citoesqueleto de actina y la protrusión de la membrana de la célula huésped alrededor del esporozoíto para formar una vacuola parasitófora, donde el microorganismo permanece en posición intracelular pero extracitoplasmática. Dentro de la vacuola, el parásito, que en este estadio recibe el nombre de trofozoíto, comienza un ciclo de multiplicación asexual (esquizogonia o merogonia) y luego continúa con una multiplicación sexual (gametogonia). Durante el ciclo de proliferación asexual se forman merontes de los cuales emergen merozoítos capaces de infectar otras células del huésped, en las que iniciarán otra merogonia o, alternativamente, una gametogonia para diferenciarse en estadios sexuales llamados gamontes (gametocitos).
Durante la gametogénesis, los gametocitos masculinos liberan varias microgametas, mientras que los gametocitos femeninos se diferencian en una única macrogameta. Luego de la fertilización el estadio diploide resultante (zigoto) sufre meiosis, mecanismo que restaura el estado haploide. A partir de aquí se inicia el proceso de esporogonia en el cual el zigoto sufre uno o más ciclos de división mitótica para formar un ooquiste que contiene los esporozoítos infectivos. Si bien se asume que la localización normal en un huésped inmunocompetente es el tracto gastrointestinal, en individuos inmunocomprometidos se han descripto fases extraintestinales en vías aéreas, árbol biliar, hígado, vejiga y páncreas. Cryptosporidium es un patógeno entérico que desencadena una enfermedad diarreica cuya morbilidad y mortalidad son significativas tanto para los seres humanos como para los animales. El desarrollo de nuevas técnicas moleculares ha permitido identificar a los genotipos C. hominis y C. parvum como aquellos que con mayor prevalencia infectan al hombre. Las rutas de transmisión son múltiples (persona a persona, animales a personas, agua, alimentos, aire) y la enfermedad puede afectar a individuos inmunocomprometidos o no. Es un microorganismo emergente cosmopolita cuya aparición no está limitada a ninguna región geográfica o al grado de desarrollo tecnológico de la misma. Los procesos de urbanización acelerados, la expansión de la pobreza, las migraciones no controladas de gran número de refugiados, la facilidad y rapidez en los desplazamientos, el movimiento creciente de animales y de productos de origen animal, la falta de saneamiento ambiental, son algunos de los factores que, sumados a la escasez de normas legales regulatorias, han posibilitado la dispersión de la enfermedad. La resistencia a los antibióticos incrementa las tasas de morbilidad y mortalidad y los gastos de atención médica asociados con el control de brotes epidémicos. La criptosporidiosis, entonces, representa una amenaza de alcance mundial que exige una respuesta coordinada de los servicios de salud pública de todos los países. Los quistes ingeridos se localizan en el tubo digestivo (desde la faringe al recto) con mayor frecuencia en el intestino delgado (yeyuno). Se ubican en el glicocálix del enterocito donde se desenquistan y cada uno elimina cuatro esporozoítos que invaden las células epiteliales. Allí cumplen un ciclo asexuado y otro sexuado que resulta en el ooquiste infectante eliminado a la luz intestinal. El parásito en las microvellosidades determina la malabsorción de nutrientes y la retención de agua en la luz intestinal lo que desencadena la diarrea osmótica. Además es la causa del edema y la atrofia de las vellosidades lo que resulta en una disminución de la superficie de absorción. Las heces humanas son infectantes a partir de los 5 - 21 días de la infección. El período de incubación es de 1 a 21 días (promedio 7). Cursa con una diarrea aguda secretora (puede ser mayor de 3 litros/día) con importante pérdida de electrolitos, dolor abdominal difuso, borborigmos, náuseas, vómitos, hiporexia y pérdida de peso.
Las heces son líquidas, abundantes, oscuras, malolientes y en un promedio de 6 / día. En las personas inmunocompetentes la enfermedad dura 3-27 días (se autolimita) y en los inmunocomprometidos mas de 1 mes, pudiendo llevar a la caquexia y la muerte. Las lesiones histológicas asociadas con la criptosporidiosis intestinal no son características. El contacto inicial entre el parásito y el glicocálix de la célula huésped, produce un acortamiento o ausencia de las microvellosidades, con atrofia y aumento de tamaño de la cripta. Se observa en la mucosa y hasta la lámina propia un infiltrado moderado de células mononucleares. El yeyuno es la localización intestinal en donde existe mayor infección. Se ha encontrado diseminación en pacientes inmunosuprimidos, principalmente con SIDA, a faringe, esófago, estómago, duodeno, ileum, colédoco, apéndice, colon, recto y pulmones, en cuyo caso pueden encontrarse los ooquistes en el esputo. En las personas inmunocompetentes, el período de incubación varía entre 3 y 12 días. La sintomatología puede fluctuar entre la sensación de indigestión y un cuadro de enteritis con diarrea de tipo agudo o crónico. Algunas personas pueden tenerla infección totalmente asintomática. En otras aparece la diarrea pero la infección se autolimita. Algunos autores la asocian con el síndrome conocido como diarrea del viajero. La diarrea generalmente es acuosa, sin moco ni sangre, la mayoría de las veces sin leucocitos. Se presenta con 5 a 10 episodios diarreicos al día, después de un tiempo puede seguirle la constipación. En niños con diarrea intensa o crónica, se puede asociar a deshidratación. Los pacientes se quejan de dolores abdominales, ocasionalmente fiebre, cefalea, anorexia, vómito y pérdida de peso. Generalmente la enfermedad se autolimita a 10-14 días. En una cuarta parte de los pacientes puede llegar a más de un mes. La mayoría de los casos no requieren tratamiento antidiarreico. Los parásitos desaparecen entre 4 y 6 semanas. En los pacientes con SIDA, además de la localización intestinal, se ha encontrado diseminación con complicación pulmonar. Causa una neumonía intersticial con intensa tos seca y sibilancias. Se han informado casos de colecistitis, con colestasis, fiebre, dolor abdominal y marcada pérdida de peso. Se han comunicado casos de pancreatitis, laringotraqueítis y sinusitis. La enfermedad es más frecuente en los pacientes con SIDA, pero también ocurre en otras inmunodeficiencias como hipogammaglobulinemia, terapia inmunosupresora, desnutrición, leucemia, linfoma y otros defectos de la inmunidad.
En los pacientes con deficiencias inmunes, los síntomas son más intensos y de larga duración. La diarrea es crónica y ocurre una enfermedad debilitante con malestar, anorexia y fiebre. Hay pérdida de líquidos y electrólitos que pueden causar enfermedad grave o muerte por deshidratación. El diagnóstico de la criptosporidiosis se hace por el hallazgo de ooquistes en las materias fecales o en material obtenido del duodeno por la cuerda de Beal (Entero tests). En las preparaciones con solución salina y lugol se pueden observar unas estructuras redondeadas u ovoides de pared definida, como "huecos vacíos", de tamaño uniforme, refringentes, algunas veces con estructuras granulares internas, que no son fáciles de identificar. La técnica más precisa es la coloración por el método de Ziehl-Neelsen modificado, sin utilizar el calentamiento de la placa. Se observan los ooquistes ácido-resistentes, de color rojo brillante sobre fondo azul. En algunos se ven unos corpúsculos internos que corresponden a los esporozoítos. Otras coloraciones que se utilizan son Kinyoun y Giemsa. Para concentrar ooquistes de Cryptosporidium se realizan las técnicas de Ritchie modificada que usa formol-éter y la de Sheather que es una flotación con azúcar. Ambas son similares en efectividad. Es necesario tener precaución en la manipulación de muestras de pacientes con SIDA. La identificación de los ooquistes también se hace con inmunofluorescencia directa, para la cual hay estuches comerciales. Existen también estuches para identificar antígenos específicos de Cryptosporidium por métodos inmunoenzimáticos. Se han comparado los 3 métodos diagnósticos más utilizados: visualización de los ooquistes con Ziehl-Neelsen o con inmunofluorescencia y la identificación de antígenos por ELISA en materia fecal y se ha encontrado que todos tienen sensibilidad y especificidad de 96% a 98%, por lo cual la escogencia depende de las posibilidades de los laboratorios y de los costos de los reactivos. En biopsia intestinal se puede observar la atrofia de las vellosidades del intestino y la hipertrofia de las criptas, en donde se localiza el parásito. Se logran definir distintos estadios mediante las coloraciones comunes de hematoxilina - eosina, en donde se ven de color violeta. También se usa la técnica de plata - metenamina, Giemsa, Kinyoun y la inmunoperoxidasa. Es posible también demostrar anticuerpos circulantes con inmunofluorescencia indirecta y con técnicas de ELISA. En los estudios serológicos se consideran significativos para el diagnóstico los títulos de 1:40 o superiores. Análisis de alimentos y otras muestras: Investigación de ooquistes por microscopía, uso de técnicas de biología molecular. El tratamiento de base, apunta a un equilibrio del aporte hidroelectrolítico (reposición de pérdidas) y de nutrientes. Se ha logrado una eficacia del 50 % en el tratamiento de los adultos con 2-3 g/día de espiromicina durante 7-30 días. Las medidas de prevención y control estarán basadas en las básicas para casi todas las EPTA:
ARISTOTELES








Comentarios
Publicar un comentario