Microbiología de los alimentos (Parte 14)
"El día que perdamos la humildad, habremos puesto el primer ladrillo para construir el edificio de nuestro fracaso"
(Mahatma Gandhi)
MICROBIOLOGÍA DE LOS ALIMENTOS
(Parte 14)
b. ALIMENTOS
Hay una serie de razones que justifican la necesidad de analizar los alimentos para determinar cualitativa o cuantitativamente sus microorganismos. los principales objetivos del análisis microbiológico son asegurar:
(1) que el alimento cumple ciertas normas estatutarias;
(2) que se ajusta a normas internas establecidas por la compañía procesadora y a las externas exigidas por el comprador;
(3) que las materias alimenticias que llegan a la factoría para ser procesadas cumplen las normas exigidas y las pactadas con el productor;
(4) que se mantienen el control del proceso y la higiene de la línea de fabricación.
Los métodos del examen microbiológico utilizados para controlar la calidad del alimento son en sí mismos muy variados y dependientes, en gran parte, del alimento que va a ser analizado. Conviene estudiar los análisis bajo los siguientes encabezamientos:
1. Estimación del número total de microorganismos.
2. Estimación del número de microorganismos indicadores.
3. Examen o estimación del número de microorganismos alterantes de los alimentos y de otros grupos especiales.
4. Examen o estimación del número de microorganismos productores de toxiinfecciones alimentarias y de los microorganismos patógenos transportados por los alimentos.
5. Análisis de los productos metabólicos de los microorganismos; a menudo requieren técnicas más sofisticadas de las que sólo disponen los laboratorios mejor dotados.

Uno de los mayores problemas del análisis microbiológico de los alimentos es determinar el número de muestras de un lote o de un día de trabajo que deben analizarse para asegurar que el producto o material alimenticio cumple la norma exigida. Obviamente cuanto mayor sea el número de muestras tomadas, mayor será la confianza en los resultados, pero puesto que el alimento empleado con fines analíticos representa un gasto no recuperable, debe alcanzarse un compromiso entre la exactitud de los resultados y la economía del análisis. los esquemas de muestreo, actualmente en uso, implican el análisis de cinco o diez muestras por lote, o de la raíz cuadrada del número de envases por lote; sin embargo, podría argüirse que una cantidad tan grande de muestras está totalmente injustificada cuando se obtienen resultados concordantes buenos.

Por lo tanto, las fuentes microbianas disponibles deben usarse prudentemente y el muestreo será máximo con los alimentos que se sabe que son microbiológicamente peligrosos y con los que dan resultados erráticos; el muestreo será también grande con los que se han sometido a un cambio de procesado y siempre que haya tenido lugar un fallo en la línea de procesado. También debe tenerse en cuenta que el número de análisis se ve afectado por la razón o causa que lo motiva; así, se necesitan menos pruebas para la confirmación de un estándar o norma satisfactorio que cuando el fin perseguido es la eliminación de un producto no satisfactorio. Cualquier esquema de muestreo digno debe tener una base estadística y a los lectores que necesiten mayor información sobre tales esquemas les recomiendo la lectura de Microorganismos de los alimentos, Vol. 2 (Comisión Internacional de Especificaciones Microbiológicas para los Alimentos, ICMSF, 1974* - *Esta obra ha sido publicada en español por EDITORIAL ACRIBIA, S. A., Zaragoza) en donde encontrarán todos los datos que precisen. La Comisión Internacional (ICMSF), citada en el punto anterior, define a la “muestra representativa” como aquélla cuyo estado es tan parecido como sea posible a la del lote (o partida) del que se tomó. Por lo tanto, es necesario evitar todo tipo de perjuicio y asegurarse de que se toman suficientes muestras. Como mejor se realiza esto es mediante el muestreo al azar, utilizando tablas de números aleatorios según recomienda la Comisión (ICMSF, 1974). Sin embargo, debe tenerse en cuenta el posible aumento de microorganismos en el equipo y por lo tanto en el alimento, durante la producción de una partida; el producto suele contener muchos menos microorganismos al comienzo que a la terminación del trabajo de la fábrica, lo que deberá tenerse presente en cualquier esquema de muestreo. De otra parte, si el equipo se ha limpiado mal, los alimentos pueden contaminarse mucho al iniciarse el trabajo. En consecuencia, puede ser ventajoso retirar los productos a intervalos de tiempo regulares; ello no supone una depreciación del muestreo al azar y se emplea frecuentemente.

Otras dificultades del muestreo derivan de la consistencia heterogénea del producto alimenticio y si el alimento no es homogéneo se requiere un muestreo más frecuente. Como ejemplos extremos se pueden citar la leche, de la que sólo se requiere una pequeña muestra del alimento bien mezclado y algunos de los productos actuales, compuestos de múltiples ingredientes, lo que puede hacer imposible obtener la cantidad requerida de cada uno para contar con una muestra representativa; consecuentemente debe hacerse un análisis por separado de cada componente. Cuando los microorganismos se limitan a zonas específicas del alimento el muestreo es en ocasiones deliberadamente desequilibrado, por ejemplo, en alimentos como la carne, el pescado y la fruta la mayoría de sus microorganismos se localizan en las superficies externas y son éstas, por lo tanto, las que constituyen las principales regiones de muestreo. Los alimentos líquidos no presentan problemas y corrientemente se muestrean con pipetas después de mezclarse bien. Los alimentos sólidos los presentan a menudo, por lo que para superar las dificultades de la toma de muestras se utilizan diversas técnicas.

En alimentos cuyas unidades son relativamente manejables, como aves y pescado, la canal entera se lava con agitación en un medio de muestreo líquido, si bien se admite que con tal tratamiento sólo se recupera una parte de la flora; se obtienen recuentos mayores si se incluyen en la solución de lavado abrasivos, como arena estéril. Durante muchos años se han usado mucho para el muestreo de superficies las torundas de algodón húmedo, pues tienen la ventaja de ser de fácil manejo y cuando se utilizan conjuntamente con una lámina metálica, dotada de ventana, permiten la toma de muestra de un área superficial equivalente; después de frotada dicha área, el soporte de la torunda se rompe y aquélla se separa y deja caer en un diluyente agitándose entonces para separar los microorganismos del algodón. Las recuperaciones alcanzadas con estas técnicas de la torunda son pobres, debido a la adherencia de los microorganismos a la superficie del alimento y a su retención en la torunda, pero pueden mejorarse, si al área muestreada vuelve a frotarse con otra torunda seca. los métodos del agar de contacto, en los que un medio estéril sólido a base de agar se presiona contra la superficie a muestrear, dan recuentos todavía menores que los de las técnicas de la torunda, pero constituyen el sistema de muestreo de uso más sencillo ya que el medio puede someterse a incubación directamente. En el caso de carnes, pescados y aves, los recuentos más altos se obtienen con el llamado «muestreo destructivo». Pueden tomarse muestras con sacabocados pre esterilizados, lo que tiene la ventaja de que se analiza un área superficial conocida que varía con el diámetro del sacabocados utilizado. Escalpelos y cuchillas también son bastante populares, pero con tales instrumentos la relación área superficial/volumen es imposible de controlar.
También pueden tomarse muestras de áreas conocidas empleando un escarificador dérmico y un cilindro metálico estéril que contiene el diluyente (Barnes et al., 1973). Las carnes picadas y los alimentos graniformes, como guisantes y harina, son más fáciles de muestrear ya que pueden tomarse pesos conocidos. Algunas de las técnicas de muestreo microbiano estudiadas más atrás sirven también para el examen del equipo de procesado de los alimentos, por ej., el lavado con un volumen conocido de agua o de diluyente, el empleo de torundas, posiblemente con lámina metálica y los métodos del agar de contacto. Excepto cuando se emplean torundas o lavados, se toma un peso conocido de la muestra del alimento (por ej., 10 ó 25 g). El alimento se adiciona a un diluyente estéril adecuado, como solución de Ringer diluida al 1/4 o agua de peptona al 0,1 % y se trata a continuación de forma que se liberen en el diluyente los microorganismos del alimento.
El tratamiento implica un mezclado mecánico o un pase por el Stomacher. En esta última técnica, muy popular actualmente, la muestra, junto con un volumen conocido de diluyente, se coloca en una bolsa de plástico estéril que es golpeada por una especie de paletas en el interior del Stomacher. El volumen de diluyente utilizado generalmente es nueve veces mayor que la muestra (por ej., 25 g de guisantes en 225 ml de diluyente) de forma que se obtenga un homogeneizado 10-1, a partir del cual se preparan las correspondientes diluciones (10-2, 10-3, 10-4, etc.) dependiendo de la calidad microbiológica del alimento o superficie objeto del análisis. Una de las pruebas microbiológicas más corrientes llevadas a cabo en los alimentos es el recuento viable total, conocido también como recuento estándar en placa y recuento aeróbico en placa. Para ello se siembran diluciones adecuadas de una muestra de los alimentos en medios de agar que contienen nutrientes suficientes para permitir el crecimiento del mayor número posible de microorganismos. los nutrientes de que se compone, por ejemplo el agar nutritivo, (Nutritive Agar, Oxoid) son: extracto de carne, extracto de levadura y peptona (un hidrolizado enzimático de carne fresca que contiene diversas sales inorgánicas, factores de crecimiento y péptidos). El pH del medio se ajusta generalmente a 7 – 7,4 para recuperar las bacterias y no los mohos y levaduras.
Las células bacterianas individuales, transferidas a la placa con el diluyente, se multiplican normalmente durante la incubación. Así puede hacerse una estimación del número total de células viables (es decir, células capaces de crecer en el medio de recuperación) en la dilución sembrada, calculando después de la incubación el recuento del número total de colonias bacterianas que se desarrollan; naturalmente en las condiciones aerobias normales crecerán las aerobias obligadas y las aerobias facultativas. Para estar seguro de que el cultivo es puro, repetir el proceso entero; para ello tomar una colonia aislada y sembrar por estrías una segunda placa. Las temperaturas de incubación seleccionadas dependen del alimento que va a examinarse. Las temperaturas corrientemente utilizadas son 45º C para las termófilas, 37º C para las mesófilas y 20º C para mohos y levaduras. Mientras la última temperatura es conveniente para las bacterias psicrótrofas y también para muchas mesófilas, para una estimación más exacta de las psicrótrofas se utilizan a veces temperaturas más bajas (por ej., 1 – 7º C); debe recordarse siempre que ninguna temperatura de incubación excluye por completo a todos los microorganismos de otro grupo. Son muchas las técnicas en placa empleadas para la enumeración del número total de bacterias viables, de las que describiremos brevemente cinco. La enumeración de las colonias se lleva a cabo tradicionalmente de forma manual, con el empleo de un contador de colonias iluminado, con cuya ayuda el laborante cuenta cada colonia individual (véase más abajo). Esta operación puede ser tediosa e inexacta, salvo que en el medio de cultivo haya crecido un número adecuado de colonias (idealmente menos de 300, si bien por razones estadísticas se requieren también como mínimo 30 colonias). En los últimos años se han ideado una serie de instrumentos de recuento automático de colonias que permiten obtener en pocos segundos recuentos exactos.
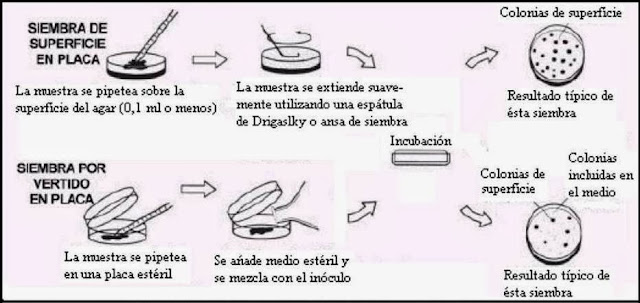
En el método de vertido en placa, se vierten en una serie (o mejor dos series) de placas de Petri alícuotas de 1 ml de las diluciones apropiadas del alimento. A continuación se adicionan a cada placa unos 10 – 15 ml de agar nutritivo fundido, enfriado a 45º C, y se mezcla cuidadosamente con la alícuota correspondiente. Después de solidificado el agar, se incuban las placas a la temperatura requerida durante un tiempo que depende de las condiciones de incubación (por ej., 1 – 2 días a 37º C, 3 – 4 días a 20º C y 7 – 10 días a 5º C). Después de la incubación se contarán las colonias de las placas que contienen entre 30 y 300 colonias; a partir de este recuento puede calcularse fácilmente el número de bacterias viables por gramo (o por cm2) de alimento. En el método de extensión en placa, se vierte previamente el medio en placas de Petri y se deja solidificar; a continuación se extienden uniformemente por la superficie alícuotas de 0,1 ml de las correspondientes diluciones mediante el empleo de varillas de vidrio estériles en forma de L (Espátula de Drigalsky).
Las placas se incuban como antes. Las ventajas de esta técnica son: primero que las células bacterianas termosensibles (esto es las psicrótrofas) no se destruyen por el agar fundido, lo que podría ocurrir, en cierta extensión con el método anterior, si la temperatura del agar es demasiado alta; segundo, todas las colonias crecen en la superficie del agar y pueden observarse y picarse fácilmente si fuera necesario, mientras que en el método de vertido en placa muchas colonias se desarrollan incrustadas en el agar, teniendo menor tamaño y siendo más difíciles de subcultivar. Con esta técnica de la gota en placa, también se emplea un medio de agar solidificado. Se utilizan pipetas especialmente calibradas que vierten 0,02 ml por gota. En la superficie de la placa se dejan caer cinco gotas separadas (o sea 0,1 ml) que se dejan secar antes de la incubación. Sólo deben contarse las placas cuyas diluciones producen 20 colonias por gota. Puesto que los métodos citados además de requerir bastante tiempo son caros en material, se ha desarrollado otro más rápido que utiliza menores cantidades, es el método de la «gotita de agar». En esta técnica las diluciones se preparan con agar fundido y las colonias se desarrollan en las gotas solidificadas (0,1 ml) durante la incubación. El recuento de las colonias se facilita empleando un visor de proyección que amplía las gotitas unas diez veces aproximadamente. Otro método semiautomático, cada vez más popular, es el de la placa en espiral, en el que una máquina vierte continuamente un volumen conocido de muestra en la superficie de una placa de agar que gira. La cantidad de muestra depositada disminuye a medida que el tubito dosificador se desplaza desde el centro a la periferia de la placa girante; de esta forma durante la incubación las colonias bacterianas se desarrollan siguiendo un trazo en espiral.
El recuento puede realizarse manualmente empleando una red de contaje o mediante contadores de colonias basados en rayos láser, especialmente diseñados para su empleo con esta técnica. Comparaciones realizadas con métodos más tradicionales han demostrado que no hay diferencias significativas en los recuentos obtenidos. A medida que los microorganismos se multiplican en un medio de crecimiento, acaecen diminutos cambios de impedancia que pueden medirse haciendo pasar por el medio una pequeña corriente eléctrica. A una concentración concreta de microorganismos tiene lugar un cambio marcado de impedancia y como es lógico, con una carga bacteriana inicial más alta esta concentración umbral se alcanza antes. Así puede estimarse el número de microorganismos inicialmente presentes en el alimento; para ello se registra el tiempo requerido (tiempo de detección) para alcanzar el umbral, empleando muestras del alimento diluidas en un medio de crecimiento. Se ha demostrado que hay una buena concordancia entre los recuentos viables convencionales y los tiempos de detección. Además, los tiempos requeridos para los análisis son normalmente de unas 5 horas lo que permite estimar rápidamente la calidad. En ocasiones puede necesitarse obtener el número total de microorganismos (esto es, células viables y muertas) de nuestros alimentos como, por ejemplo, alimentos enlatados y leche pasteurizada. En portaobjetos de vidrio se hacen extensiones de la muestra, generalmente diluida, que se tiñen con un colorante adecuado. Se cuenta el número total de células microbianas de un número dado de campos microscópicos y del recuento obtenido puede calcularse aproximadamente el número total de microorganismos por gramo de alimento.
El análisis rutinario de los alimentos para poner de manifiesto un amplio rango de bacterias patógenas es impracticable en la mayoría de los laboratorios, bien porque están inadecuadamente dotados, bien porque el tamaño de la muestra impediría su manejo convenientemente. Por ello se ha convertido en práctica corriente investigar en los alimentos la existencia de bacterias que indican la posibilidad de la presencia de las productoras de toxiinfecciones alimentarias o de otras patógenas. Por ello se les denomina «microorganismos indicadores» y se catalogan frecuentemente como de gran importancia al establecer la seguridad y calidad microbiológica de los alimentos. Las principales bacterias empleadas como indicadores son coliformes, enterococos y, más recientemente, enterobacteriáceas. En ocasiones resultan una buena guía los recuentos viables totales a 37º C, si bien su relación con la seguridad de los alimentos es más bien débil. Una vez que se obtiene un cultivo puro, normalmente se ha de propagar (se le hace crecer de nuevo). Seguramente, el investigador deseará obtener más células para poder trabajar con ellas. Para cultivar microorganismos en el laboratorio, se ha de preparar un medio de cultivo, líquido o sólido, con todos los nutrientes necesarios para su crecimiento. Los medios sólidos se hacen generalmente, añadiendo agar a los líquidos. El tipo de medio que utiliza un microbiólogo depende del microorganismo que está cultivando y el porqué de dicho cultivo. Los microorganismos presentan una enorme variedad de requerimientos nutricionales. Se utiliza un medio mínimo para determinar los requerimientos nutricionales de un organismo y un medio rico si se desea obtener masa celular de una forma rápida. Los medios se pueden formular para el desarrollo de una especie o para distinguir entre especies o cepas. Por tanto, los medios se clasifican en definidos, complejos o indefinidos, selectivos, diferenciales, selectivos – diferenciales y de enriquecimiento, dependiendo de su composición y uso. Un medio definido es aquel del cual conocemos su composición química exacta, porque ha sido preparado a partir de compuestos químicos puros. Escherichia coli es capaz de crecer en un medio químicamente definido, de composición bastante sencilla. Este microorganismo requiere una fuente de carbono orgánica (por ejemplo, glucosa), pero puede obtener el resto de los nutrientes esenciales a partir de sales minerales.
En cambio, otros organismos, denominados exigentes, requieren medios químicamente muy complejos. Por ejemplo, la bacteria Leuconostoc citrovorum es extraordinariamente exigente ya que requiere un medio con muchos ingredientes. Los medios definidos se usan generalmente para realizar estudios genéticos, pero sus inconvenientes a menudo sobrepasan sus ventajas. Así, se requiere un tiempo considerable para preparar un medio definido y las bacterias crecen más despacio en ellos. Además, no conocemos los requerimientos nutricionales de todas las bacterias y, por tanto, no siempre pueden utilizarse. Los medios complejos, se preparan a partir de extractos de productos naturales tales como carne, sangre, caseína (la proteína de la leche), levaduras o soja. Un medio líquido complejo se denomina caldo. La caseína u otras proteínas que se añaden a los medios son usualmente hidrolizadas con enzimas o en medio ácido, para hacerlas más solubles y, por tanto, más fáciles de utilizar nutricionalmente. Una hidrólisis parcial rompe las proteínas en péptidos. Una hidrólisis total las degrada hasta aminoácidos. A las proteínas parcialmente hidrolizadas se les denomina peptonas. Entre las peptonas comerciales se encuentra la proteosa – peptona, la triptona y la triptosa. A la caseína totalmente hidrolizada se le denomina hidrolizado de caseína. Los diversos componentes de un medio complejo se venden como polvos deshidratados. También existen ya cientos de mezclas complejas que se comercializan como medios complejos específicos. Uno de estos medios es el caldo nutritivo, probablemente el medio complejo que más se utiliza. Cuando este medio se solidifica con agar, se denomina agar nutritivo. Generalmente se prefiere la utilización de los medios complejos, ya que son fáciles de preparar y permiten un crecimiento rápido de los microorganismos. Un medio selectivo favorece el crecimiento de ciertos microorganismos, mientras suprime el crecimiento de otros. Los medios selectivos se utilizan para aislar especies particulares a partir de una mezcla compleja. Por ejemplo, se utiliza un medio selectivo, para aislar Salmonella typhi, agente causal de la fiebre tifoidea, a partir de heces donde existen cientos de microorganismos diferentes. Algunos medios son selectivos porque contienen un producto químico, como la azida sódica, el telurito potásico o el cristal violeta, que inhiben el desarrollo de algunos microorganismos pero no de otros.
El agar SPS (denominado de esta forma porque contiene sulfadiazina y sulfato de polimixina) se utiliza para identificar Clostridium botulinum, agente causal de una grave intoxicación alimentaria. El medio SPS permite el crecimiento de esta bacteria, pero inhibe el de otras especies de Clostridium. otros medios de cultivo selectivos utilizan un valor extremo de pH o una fuente de carbono poco común. Los medios diferenciales se utilizan para identificar las colonias de un determinado microorganismo. Por ejemplo, para identificar Streptococcus pyogenes, la bacteria que causa la escarlatina, se utiliza el medio de agar sangre es un agar que contiene hematíes. Las colonias de esta bacteria muestran a su alrededor una zona transparente debido a que producen hemólisis (muerte y lisis de los hematíes). Escherichia coli y las bacterias relacionadas con ella se identifican en medios con un indicador de pH porque originan productos metabólicos ácidos, que cambian el color del indicador y por tanto de sus colonias. Algunos medios son selectivos y diferenciales al mismo tiempo. El agar MacConkey es un ejemplo de medio selectivo – diferencial, utilizado para detectar cepas de Salmonella y Shigella, bacterias entéricas (del intestino) que causan disenterías. Cualquier muestra de heces enviada al laboratorio esta plagada de bacterias pertenecientes a muchas especies. El agente selectivo del MacConkey actúa como una especie de tamiz grosero que disminuye el campo de identificación. El cristal violeta y las sales del medio inhiben el crecimiento de la mayoría de las bacterias Gram positivas (Salmonella y Shigella son Gram negativas). A partir de aquí, el componente diferencial del medio, en este caso la lactosa, comienza a ser importante. Salmonella y Shigella no fermentan la lactosa, pero la mayor parte de las enterobacterias sí lo hacen. Por tanto, las colonias de estas dos bacterias serán rojas, mientras que las restantes no lo serán. Un medio de cultivo se formula para suministrar todos los nutrientes que un microorganismo necesita para crecer, pero esto no es suficiente. En el laboratorio, también es preciso aportar las condiciones ambientales adecuadas. Tanto la temperatura como el pH deben estar dentro del intervalo apropiado; con respecto al oxígeno, según el caso, será aportado o eliminado. En la rutina diaria del trabajo de microbiología de agua y alimentos, y reglamentadas por los principales Organismos de Control Internacionales (CODEX ALIMENTARIUS, ICMSF, AOAC) y Nacionales (CÓDIGO ALIMENTARIO ARGENTINO), se llevan a cabo las siguientes marchas de investigación y aislamiento de patógenos, de acuerdo a lo legislado como “Criterios Microbiológicos” para cada alimento en particular y que serán descriptas e ilustradas en los blogs que se renovarán a continuación.

"SOMOS LO QUE HACEMOS REPETIDAMENTE. EXCELENCIA, POR LO TANTO, NO ES UN ACTO SINO UN HÁBITO"
ARISTOTELES
LEGALES: El autor no asume responsabilidad alguna por la descarga, copia, distribución, modificación o alteración de los contenidos publicados, sean propios del mismo o de terceros, los cuales pudieren estar protegidos por Copyright, Derechos de Propiedad Intelectual, Derechos de Autor, o relacionados. La Bibliografía del tema expuesto y el crédito fotográfico está en poder del Autor y no se publica dada su extensión, pero se enviará por mail al interesado que la solicitare debidamente fundamentada.



Comentarios
Publicar un comentario